题目内容
以下是三个定量分析实验:
课题Ⅰ:胆矾(CuSO4?nH2O)结晶水含量的测定
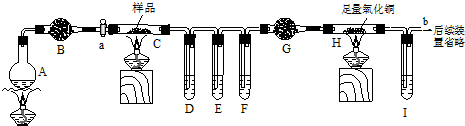
(1))在加热胆矾时,除了需要坩埚外,还需要哪些仪器:
①铁架台,②玻棒,③酒精灯,④泥三角,⑤石棉网,⑥坩埚钳
(2)加热完毕,坩埚应放在 (填仪器名称)中进行冷却,至室温.
(3)本实验中必须进行恒重操作,恒重操作时两次称量的差值必须不超过 g.
(4)若一次实验数据如下:
坩埚的质量m1=22.250g;坩埚和胆矾的质量m2=24.300g;坩埚和硫酸铜的质量m3=23.397g.
请计算:n= ;本次试验的相对误差= (均要求保留两位小数).
(5)试验结果若偏大,在检查误差产生的原因时,发现坩埚底部的硫酸铜发黑,你估计产生误差最大的可能是: .
课题Ⅰ:胆矾(CuSO4?nH2O)结晶水含量的测定
(1))在加热胆矾时,除了需要坩埚外,还需要哪些仪器:
①铁架台,②玻棒,③酒精灯,④泥三角,⑤石棉网,⑥坩埚钳
(2)加热完毕,坩埚应放在
(3)本实验中必须进行恒重操作,恒重操作时两次称量的差值必须不超过
(4)若一次实验数据如下:
坩埚的质量m1=22.250g;坩埚和胆矾的质量m2=24.300g;坩埚和硫酸铜的质量m3=23.397g.
请计算:n=
(5)试验结果若偏大,在检查误差产生的原因时,发现坩埚底部的硫酸铜发黑,你估计产生误差最大的可能是:
考点:硫酸铜晶体中结晶水含量的测定,中和滴定
专题:实验题
分析:(1)首先根据实验步骤中的各步操作,确定所需的实验仪器,硫酸铜晶体里结晶水含量的测定用到电子天平、坩埚、玻璃棒、坩埚钳、干燥器、泥三角、三脚架等仪器;
(2)为了防止加入后的硫酸铜吸收空气中水,干燥时需将硫酸铜放在干燥器中冷却;
(3)进行恒重操作,直至连续两次称量的结果相差不超过0.001g为止;
(4)根据题中数据计算出无水硫酸铜、结晶水的物质的量,再计算出胆矾中含有结晶水的数目;根据胆矾中结晶水为5计算出相对误差;
(5)测定结果偏大,坩埚底部的硫酸铜发黑,可能为氧化铜,说明加热温度过高导致硫酸铜分解.
(2)为了防止加入后的硫酸铜吸收空气中水,干燥时需将硫酸铜放在干燥器中冷却;
(3)进行恒重操作,直至连续两次称量的结果相差不超过0.001g为止;
(4)根据题中数据计算出无水硫酸铜、结晶水的物质的量,再计算出胆矾中含有结晶水的数目;根据胆矾中结晶水为5计算出相对误差;
(5)测定结果偏大,坩埚底部的硫酸铜发黑,可能为氧化铜,说明加热温度过高导致硫酸铜分解.
解答:
解:(1)测定CuSO4?nH2O的结晶水含量,操作方法为:称量样品→在坩埚中加热→冷却→称量无水硫酸铜,所以称量需电子天平,研钵常用于研磨固体物质或进行粉末状固体的混和,将硫酸铜晶体碾碎时需要用到的仪器名称为研钵,坩埚是实验室常用于灼烧固体物质的仪器,加热硫酸铜晶体需要将其盛放在坩埚中,同时需坩埚钳、泥三角、三脚架、转移固体需玻璃棒,所以需要的仪器为:②③④⑤,
故答案为:②③④⑤;
(2)加热到蓝色完全变白,然后把坩埚移至干燥器中冷却,防止硫酸铜吸收空气中的水,
故答案为:干燥器;
(3)电子天平能够读到0.001g,进行恒重操作时,为了减小误差,连续两次称量的结果相差不超过0.001g即可认为硫酸铜中 结晶水完全失去,
故答案为:0.001g;
(4)坩埚的质量m1=22.250g、坩埚和胆矾的质量m2=24.300g、坩埚和硫酸铜的质量m3=23.397g,
胆矾的质量为:24.3000g-22.250g=2.05,
无水硫酸铜的质量为:23.397g-22.250g=1.147g,硫酸铜的物质的量为:
≈0.007169mol,
结晶水的质量为:2.05g-1.147g=0.903g,结晶水的物质的量为:
=0.05017mol,
该胆矾中含有结晶水的数目为:
≈7,
胆矾中含有5个结晶水,则该实验的相对误差为:
×100%=40%,
故答案为:7;40%;
(5)坩埚底部的硫酸铜发黑,说明加热过程中温度过高,部分硫酸铜分解,导致沉淀的结晶水的质量偏大,计算结果偏大,
故答案为:硫酸铜受热分解.
故答案为:②③④⑤;
(2)加热到蓝色完全变白,然后把坩埚移至干燥器中冷却,防止硫酸铜吸收空气中的水,
故答案为:干燥器;
(3)电子天平能够读到0.001g,进行恒重操作时,为了减小误差,连续两次称量的结果相差不超过0.001g即可认为硫酸铜中 结晶水完全失去,
故答案为:0.001g;
(4)坩埚的质量m1=22.250g、坩埚和胆矾的质量m2=24.300g、坩埚和硫酸铜的质量m3=23.397g,
胆矾的质量为:24.3000g-22.250g=2.05,
无水硫酸铜的质量为:23.397g-22.250g=1.147g,硫酸铜的物质的量为:
| 1.147 |
| 160g/mol |
结晶水的质量为:2.05g-1.147g=0.903g,结晶水的物质的量为:
| 0.903g |
| 18g/mol |
该胆矾中含有结晶水的数目为:
| 0.05017mol |
| 0.007169mol |
胆矾中含有5个结晶水,则该实验的相对误差为:
| 7-5 |
| 5 |
故答案为:7;40%;
(5)坩埚底部的硫酸铜发黑,说明加热过程中温度过高,部分硫酸铜分解,导致沉淀的结晶水的质量偏大,计算结果偏大,
故答案为:硫酸铜受热分解.
点评:本题考查了硫酸铜晶体中结晶水的测定,题目难度中等,注意掌握测定硫酸铜晶体中结晶水的操作方法,能够根据实验数据计算胆矾中含有结晶水数目,试题考查了学生的分析、理解能力及化学实验能力.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
观察如图,下列叙述中错误的是( )
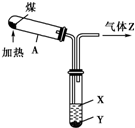

| A、图中操作发生了化学变化 |
| B、液体X的pH>7,液体Y是一种黑色黏稠状液体 |
| C、气体Z易燃,可还原CuO,但不能使溴水褪色 |
| D、试管A中得到的固体可用于工业炼铁、制粗硅等 |
合成氨反应的正反应是气体体积减小的放热反应,合成氨工业的生成流程如下:
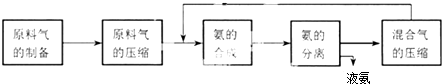
关于合成氨工业的说法中不正确的是( )

关于合成氨工业的说法中不正确的是( )
| A、混合气进行循环利用遵循绿色化学思想 |
| B、对原料气进行压缩可以增大原料气的转化率 |
| C、合成氨反应须在低温下进行 |
| D、使用催化剂可以提高反应的速率,但是不能使平衡向正反应方向移动 |
下列有关生产生活涉及的操作和原理说法正确的是( )
| A、合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 |
| B、铁钉镀锌,将锌与电源负极相连,电镀过程需要控制电流强度、溶液pH等条件 |
| C、海轮外壳绑上锌板是采用牺牲阳极的阴极保护法,从而减缓钢铁腐蚀速率 |
| D、电解精炼铜时,阳极溶解铜的总质量和阴极析出铜的总质量相等 |
CuO和Fe2O3的混合物m g,向其中加入1mol?L-1的HNO3溶液200mL恰好完全反应,若将2m g该混合物用足量CO还原,充分反应后剩余固体质量为( )
| A、3.2 g |
| B、(2m-3.2)g |
| C、(m-1.6)g |
| D、(2m-1.6)g |
某化合物的结构(键线式)及球棍模型如图1:该有机分子的核磁共振氢谱图如图2(单位是ppm):下列关于该有机物的叙述正确的是( )


| A、该有机物不同化学环境的氢原子有6种 |
| B、该有机物属于芳香化合物 |
| C、键线式中的Et代表的基团为-CH3 |
| D、该有机物在一定条件下能够发生消去反应 |