题目内容
某同学用下列装置(固定、加热仪器和橡胶管略)进行有关氨气制取的实验探究,回答下列问题.
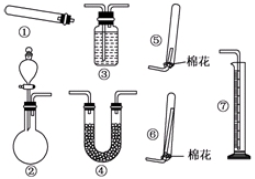
(1)装置①除了制取NH3外,还能制取 ;若要测定生成的NH3的体积,则必须选择的装置是 (填装置序号),装置中所盛试剂应具有的性质是 .
(2)若用装置②制取并收集干燥的NH3,烧瓶内装的试剂是 ,分液漏斗中装的试剂是 ,装置除②外还应选择 (填装置序号).
(3)若用下列各种试剂组合(其它条件相同)进行制取氨气的对比实验,测出氨气的体积(标准状况)如下表:
试剂:6.0g Ca(OH)2(s,过量),6.0g CaO(s,过量),5.4g NH4Cl(s),5.4g (NH4)2SO4(s).
从表中数据分析,实验室制氨气的产率(产率=
×100%)最高的是 (填序号),其原因是 .

(1)装置①除了制取NH3外,还能制取
(2)若用装置②制取并收集干燥的NH3,烧瓶内装的试剂是
(3)若用下列各种试剂组合(其它条件相同)进行制取氨气的对比实验,测出氨气的体积(标准状况)如下表:
试剂:6.0g Ca(OH)2(s,过量),6.0g CaO(s,过量),5.4g NH4Cl(s),5.4g (NH4)2SO4(s).
| 试剂组合 | ①Ca(OH)2 NH4Cl | ②Ca(OH)2(NH4)2SO4 | ③CaO NH4Cl | ④CaO(NH4)2SO4 |
| NH3体积( mL) | 1344 | 1364 | 1792 | 1753 |
| 实际产量 |
| 理论产物 |
考点:氨的制取和性质
专题:氮族元素
分析:(1)若用装置①制取NH3,则实验室用氯化铵和氢氧化钙在加热条件下制取氨气属于固体+固体加热制备气体,可以制备乙炔、甲烷;要测定氨气的体积,可以采用排液体的方法测量,且氨气和该液体不能反应、氨气不能溶于该液体、该液体不能挥发;
(2)若用装置②制取并收集干燥的NH3,是固体和液体不加热制备气体的制备方法,可以利用浓氨水滴入碱石灰中得到氨气,根据氨气的性质及密度确定收集方法;
(3)依据氮元素守恒计算生成氨气物质的量,5.4g NH4Cl(s)物质的量=
=0.1mol,5.4g (NH4)2SO4(s)物质的量=
=0.04mol,结合产率=
×100%计算分析.
(2)若用装置②制取并收集干燥的NH3,是固体和液体不加热制备气体的制备方法,可以利用浓氨水滴入碱石灰中得到氨气,根据氨气的性质及密度确定收集方法;
(3)依据氮元素守恒计算生成氨气物质的量,5.4g NH4Cl(s)物质的量=
| 5.4g |
| 53.5g/mol |
| 5.4g |
| 132g/mol |
| 实际产量 |
| 理论产物 |
解答:
解:(1)若用装置①制取NH3,则实验室用氯化铵和氢氧化钙在加热条件下制取氨气,反应方程式为2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O,固体+固体
气体的装置可以制备乙炔、甲烷;要测定氨气的体积,可以采用排液体的方法测量,且氨气和该液体不能反应、氨气不能溶于该液体、该液体不能挥发,测定生成的NH3的体积,则必须选择的装置是③⑦;
故答案为:O2;③⑦;氨气难溶于该试剂,该试剂不易挥发,不与氨气反应;
(2)若用装置②制取并收集干燥的NH3,是固体和液体不加热制备气体的制备方法,可以利用浓氨水滴入碱石灰中得到氨气,分液漏斗中是浓氨水;根据氨气的性质及密度确定收集方法,氨气极易溶于水,常温下,氨气和空气中成分不反应,且氨气密度小于空气,所以可以采用向下排空气法收集,导气管升入试管底部,氨气是碱性气体用碱石灰干燥,选择装置④⑥;
故答案为:CaO或NaOH或碱石灰,浓氨水,④⑥;
(3)依据氮元素守恒计算生成氨气物质的量,5.4g NH4Cl(s)物质的量=
=0.1mol,5.4g (NH4)2SO4(s)物质的量=
=0.04mol,结合产率=
×100%计算分析:
①Ca(OH)2 NH4Cl反应实验室制氨气的产率=
×100%=60%
②Ca(OH)2(NH4)2SO4,实验室制氨气的产率=
×100%=76%
③CaO NH4Cl,实验室制氨气的产率=
×100%=80%
④CaO(NH4)2SO4
×100%=97.8%
所以生成氨气的产率最高的是④,原因是因为NH4Cl受热易分解,生成的部分NH3和HCl又重新结合生成NH4Cl;而用Ca(OH)2反应产生的水较多,吸收的NH3较多,所以用CaO和(NH4)2SO4反应产率最高;
故答案为:④,因为NH4Cl受热易分解,生成的部分NH3和HCl又重新结合生成NH4Cl;而用Ca(OH)2反应产生的水较多,吸收的NH3较多,所以用CaO和(NH4)2SO4反应产率最高;
| ||
| ||
故答案为:O2;③⑦;氨气难溶于该试剂,该试剂不易挥发,不与氨气反应;
(2)若用装置②制取并收集干燥的NH3,是固体和液体不加热制备气体的制备方法,可以利用浓氨水滴入碱石灰中得到氨气,分液漏斗中是浓氨水;根据氨气的性质及密度确定收集方法,氨气极易溶于水,常温下,氨气和空气中成分不反应,且氨气密度小于空气,所以可以采用向下排空气法收集,导气管升入试管底部,氨气是碱性气体用碱石灰干燥,选择装置④⑥;
故答案为:CaO或NaOH或碱石灰,浓氨水,④⑥;
(3)依据氮元素守恒计算生成氨气物质的量,5.4g NH4Cl(s)物质的量=
| 5.4g |
| 53.5g/mol |
| 5.4g |
| 132g/mol |
| 实际产量 |
| 理论产物 |
①Ca(OH)2 NH4Cl反应实验室制氨气的产率=
| ||
| 0.1mol |
②Ca(OH)2(NH4)2SO4,实验室制氨气的产率=
| ||
| 0.08mol |
③CaO NH4Cl,实验室制氨气的产率=
| ||
| 0.1mol |
④CaO(NH4)2SO4
| ||
| 0.08mol |
所以生成氨气的产率最高的是④,原因是因为NH4Cl受热易分解,生成的部分NH3和HCl又重新结合生成NH4Cl;而用Ca(OH)2反应产生的水较多,吸收的NH3较多,所以用CaO和(NH4)2SO4反应产率最高;
故答案为:④,因为NH4Cl受热易分解,生成的部分NH3和HCl又重新结合生成NH4Cl;而用Ca(OH)2反应产生的水较多,吸收的NH3较多,所以用CaO和(NH4)2SO4反应产率最高;
点评:本题考查了氨气制备方法,装置和原理的分析应用,反应过程中产率的计算判断和原因分析,掌握基础是关键,题目难度中等.

练习册系列答案
 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
在①MgO、CuO、CaO、SO2;②C、Fe、S、P;③ZnCl2、BaCO3、HNO3、NaNO3三组物质中,每组各有一种物质在分类上与组内其他物质不同,这三种物质分别是( )
| A、CuO、Fe、ZnCl2 |
| B、SO2、Fe、HNO3 |
| C、CaO、C、BaCO3 |
| D、SO2、S、NaNO3 |
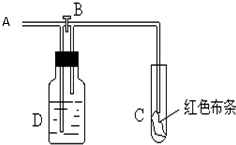 如图:A处通入氯气.关闭B阀时,C处红色布条无变化,打开B阀时,C处红色布条褪色.由此作出的判断正确的是( )
如图:A处通入氯气.关闭B阀时,C处红色布条无变化,打开B阀时,C处红色布条褪色.由此作出的判断正确的是( )| A、D中可能是浓硫酸 |
| B、通入的氯气含有水蒸气 |
| C、D中可能是水 |
| D、D中不可能是NaOH溶液 |
丁烷的二氯取代物的同分异构体共有( )
| A、8种 | B、9种 |
| C、10种 | D、11种 |
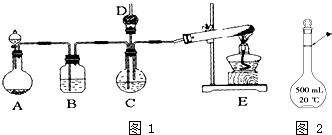 纳米碳酸钙广泛应用于橡胶、塑料、造纸、化学建材、油墨、涂料、密封胶与胶粘剂等行业.在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙.某校学生实验小组设计如图1所示装置,制取该产品.D中装有蘸稀硫酸的脱脂棉,图中夹持装置已略去.
纳米碳酸钙广泛应用于橡胶、塑料、造纸、化学建材、油墨、涂料、密封胶与胶粘剂等行业.在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙.某校学生实验小组设计如图1所示装置,制取该产品.D中装有蘸稀硫酸的脱脂棉,图中夹持装置已略去.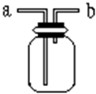 如图所示是中学化学实验中常见的装置,它有多种用途.
如图所示是中学化学实验中常见的装置,它有多种用途.