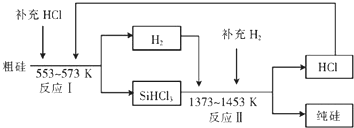
题目内容
8.下列离子方程式书写正确的是( )| A. | NH4HCO3溶于少量的浓KOH溶液中:NH4++HCO3-+2OH-═CO32-+NH3↑+2 H2O | |
| B. | 将1mol过氧化钠投入含有1molAlCl3的溶液中:6Na2O2+6H2O+4Al3+═4Al(OH)3↓+3O2↑+12Na+ | |
| C. | NaHSO4溶液中加入Ba(OH)2溶液至溶液呈中性:Ba2++OH-+H++SO${\;}_{4}^{2-}$═BaSO4↓+H2O | |
| D. | 将16.8g 铁粉投入100mL 4.0mol/L的HNO3溶液中(还原产物只有NO)6Fe+20 H++5NO3-═3Fe2++3Fe3++5NO↑+10H2O |
分析 A.氢氧化钾少量,只有碳酸氢根离子参与反应;
B.氢氧化钠与铝离子的物质的量之比为2:1,则反应生成氢氧化铝沉淀;
C.反应后溶液为中性,则硫酸氢钠与氢氧化钡的物质的量之比为2:1;
D.16.8g 铁粉物质的量=$\frac{16.8g}{56g/mol}$=0.3mol,100mL 4.0mol/L的HNO3溶液中含硝酸的物质的量=0.1L×4.0mol/L=0.4mol,依据3Fe+8HNO3═3Fe(NO3)2+2NO↑+4H2O,可知铁过量反应生成硝酸亚铁.
解答 解:A.NH4HCO3溶于少量的浓KOH溶液中,碳酸氢根离子优先反应,正确的离子方程式为:HCO3-+OH-═CO32-+H2O,故A错误;
B.将1mol过氧化钠投入含有1molAlCl3的溶液中,过氧化钠不足,反应生成氢氧化铝沉淀,反应的离子方程式为:6Na2O2+6H2O+4Al3+═4Al(OH)3↓+3O2↑+12Na+,故B正确;
C.NaHSO4溶液中加入Ba(OH)2溶液至溶液呈中性,硫酸氢钠与氢氧化钡按照物质的量2:1反应,正确的离子方程式为:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,故C错误;
D.16.8g 铁粉物质的量=$\frac{16.8g}{56g/mol}$=0.3mol,100mL 4.0mol/L的HNO3溶液中含硝酸的物质的量=0.1L×4.0mol/L=0.4mol,则将16.8g 铁粉投入100mL 4.0mol/L的HNO3溶液中(还原产物只有NO)铁粉过量,反应生成硝酸亚铁,正确的离子方程式:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O,故D错误;
故选B.
点评 本题考查了离子方程式的书写,题目难度中等,侧重考查反应物过量情况对生成物影响,明确离子方程式的书写原则为解答关键,试题有利于提高学生的分析、理解能理解及灵活应用能力.

 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | ① | |||||||
| 二 | ② | ③ | ④ | ⑤ | ||||
| 三 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ⑪ | ⑫ |
(2)⑥和⑧的最高价的氧化物的水化物中碱性较弱的是Al(OH)3(填化学式,下同);
(3)④、⑩的气态氢化物中的稳定性较强的是H2O;
(4)写出②和⑫组成的各原子最外层电子都满足8电子的物质的化学式CCl4.
| A. | “水滴石穿”说明水在重力的作用下穿透石块,只涉及物理变化 | |
| B. | “玉不琢不成器”,“百炼方能成钢”发生的均为化学变化 | |
| C. | “甘之如饴”说明糖类均有甜味 | |
| D. | “火树银花”中的焰火实质上是金属元素的焰色反应 |
| A. | ①②②③ | B. | ②①③② | C. | ②③①② | D. | ①①②③ |
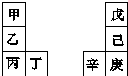 甲~辛等元素在周期表中的相对位置如表,甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素.下列判断正确的是( )
甲~辛等元素在周期表中的相对位置如表,甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素.下列判断正确的是( )| A. | 金属性:甲>乙>丁 | |
| B. | 原子半径:辛>戊>己 | |
| C. | 丙与庚的原子核外电子数相差13 | |
| D. | 乙的单质在空气中燃烧生成只含离子键的化合物 |
| A. | C、N、O最高正价依次升高 | B. | 钠、镁、铝的还原性依次减弱 | ||
| C. | HC1、HBr、HI的稳定性依次增强 | D. | H3PO4、H2SO4、HC1O的酸性依次增强 |
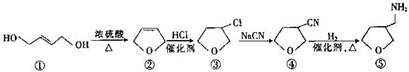
| A. | 有机物①与乙烯互为同系物 | |
| B. | 有机物③转化为有机物④的反应属于加成反应 | |
| C. | 有机物④转化为有机物⑤的反应中反应物的物质的量之比为1:1 | |
| D. | 含有一个四元环,且能与金属钠反应的有机物③的同分异构体(不考虑立体异构)有3种 |
| A. | 量筒的“0”在下方 | B. | 滴定管的“0”在上方 | ||
| C. | 移液管的“0”在尖嘴处 | D. | 托盘天平的“0”在刻度盘的中央 |