题目内容
下列说法正确的是( )
| A、室温下,pH为11的氨水与pH为3的盐酸等体积混合,溶液呈中性 |
| B、在0.1 mol/L(NH4)2Fe(SO4)2溶液中:c(H+)+c(NH4+)+c(Fe2+)═c(OH-)+c(SO42-) |
| C、向醋酸溶液中加入适量醋酸钠,所得酸性溶液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D、0.2mo1?L-1的Na2CO3溶液:c(OH-)═c(HCO3-)+c(H+)+2c(H2CO3) |
考点:离子浓度大小的比较
专题:电离平衡与溶液的pH专题,盐类的水解专题
分析:A.室温下,pH=11的氨水浓度大于pH=3的盐酸,二者等体积混合氨水有剩余,溶液呈碱性;
B.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
C.混合溶液中存在醋酸和醋酸钠,溶液呈酸性,溶液中存在电荷守恒,根据电荷守恒判断;
D.任何电解质溶液中都存在质子守恒,根据质子守恒判断.
B.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
C.混合溶液中存在醋酸和醋酸钠,溶液呈酸性,溶液中存在电荷守恒,根据电荷守恒判断;
D.任何电解质溶液中都存在质子守恒,根据质子守恒判断.
解答:
解:A.室温下,pH=11的氨水浓度大于pH=3的盐酸,二者等体积混合氨水有剩余,一水合氨电离程度大于铵根离子水解程度,所以溶液呈碱性,故A错误;
B.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(H+)+c(NH4+)+2c(Fe2+)═c(OH-)+2c(SO42-),故B错误;
C.混合溶液中存在醋酸和醋酸钠,溶液呈酸性,溶液中存在电荷守恒,根据电荷守恒得c(Na+)<c(CH3COO-),故C错误;
D.任何电解质溶液中都存在质子守恒,根据质子守恒得c(OH-)═c(HCO3-)+c(H+)+2c(H2CO3),故D正确;
故选D.
B.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(H+)+c(NH4+)+2c(Fe2+)═c(OH-)+2c(SO42-),故B错误;
C.混合溶液中存在醋酸和醋酸钠,溶液呈酸性,溶液中存在电荷守恒,根据电荷守恒得c(Na+)<c(CH3COO-),故C错误;
D.任何电解质溶液中都存在质子守恒,根据质子守恒得c(OH-)═c(HCO3-)+c(H+)+2c(H2CO3),故D正确;
故选D.
点评:本题考查离子浓度大小比较,明确溶液中的溶质及其性质是解本题关键,知道溶液中存在电荷守恒、物料守恒,结合守恒思想分析解答.

练习册系列答案
相关题目
在常温常压下,下列各组气体不能大量共存的是( )
| A、N2与H2 |
| B、NO2与NO |
| C、N2与O2 |
| D、NH3与HCl |
被称之为“软电池”的纸质电池,采用一个薄层纸片作为传导体,在其一边镀锌,而在其另一边镀二氧化锰.在纸内的离子“流过”水和氧化锌组成的电解液.电池总反应为:Zn+2MnO2+H2O═ZnO+2MnO(OH).下列说法正确的是( )
| A、该电池的正极为锌 |
| B、该电池反应中二氧化锰起催化剂作用 |
| C、电池负极反应式为:Zn+2OH--2e-═ZnO+H2O |
| D、当 0.l mol Zn 完全溶解时,流经电解液的电子个数为1.204×l023 |
将一定质量的镁、铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3mol/L NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列有关叙述中正确的是( )
| A、加入合金的质量不可能为6.4 g |
| B、参加反应的硝酸的物质的量为0.1 mol |
| C、沉淀完全时消耗NaOH溶液的体积为150 mL |
| D、溶解合金时收集到NO气体标准状况下的体积为2.24 L |
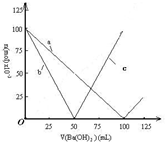 烧杯中盛有100mL 0.1mol/L的NaHSO4溶液,向其中逐滴滴加0.1mol/L的Ba(OH)2溶液,烧杯中某些物质(或微粒)的物质的量的变化曲线如图.下列说法正确的是( )
烧杯中盛有100mL 0.1mol/L的NaHSO4溶液,向其中逐滴滴加0.1mol/L的Ba(OH)2溶液,烧杯中某些物质(或微粒)的物质的量的变化曲线如图.下列说法正确的是( )| A、曲线a表示Ba2+的物质的量的变化 |
| B、曲线c表示OH-的物质的量的变化 |
| C、加入Ba(OH)2溶液50mL反应的离子方程式为Ba2++OH-+H++SO42-→BaSO4↓+H2O |
| D、加入Ba(OH)2溶液大于50mL后,反应的离子方程式为 OH-+H+→H2O |
