题目内容
将一定质量的镁、铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3mol/L NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列有关叙述中正确的是( )
| A、加入合金的质量不可能为6.4 g |
| B、参加反应的硝酸的物质的量为0.1 mol |
| C、沉淀完全时消耗NaOH溶液的体积为150 mL |
| D、溶解合金时收集到NO气体标准状况下的体积为2.24 L |
考点:有关混合物反应的计算
专题:计算题
分析:将一定量的镁和铜组成的混合物加入到稀HNO3中,金属完全溶解(假设反应中还原产物只有NO),发生反应:3Mg+8HNO3(稀)=3Mg(NO3)2+2NO↑+4H2O、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,向反应后的溶液中加入过量的3mol/L NaOH溶液至沉淀完全,发生反应:Mg(NO3)2+2NaOH=Mg(OH)2↓+2NaNO3、Cu(NO3)2+2NaOH=Cu(OH)2↓+2NaNO3,沉淀为氢氧化镁和氢氧化铜,生成沉淀的质量比原合金的质量增加5.1g,则氢氧化镁和氢氧化铜含有氢氧根的质量为5.1g,氢氧根的物质的量为
=0.3mol,根据电子转移守恒,则镁和铜的总的物质的量为0.15mol,
A.根据电子注意计算金属总物质的量,金属的总质量与金属的含量有关,假定全为镁、全为铜计算确定金属的质量范围;
B.根据方程式可知参加反应的n反应(HNO3)=
n(金属);
C.n(NaOH)=n(OH-),根据V=
计算加入的氢氧溶液的体积;
D.根据电子转移守恒计算n(NO),然后计算出标况下一氧化氮的体积.
| 5.1g |
| 17g/mol |
A.根据电子注意计算金属总物质的量,金属的总质量与金属的含量有关,假定全为镁、全为铜计算确定金属的质量范围;
B.根据方程式可知参加反应的n反应(HNO3)=
| 8 |
| 3 |
C.n(NaOH)=n(OH-),根据V=
| n |
| c |
D.根据电子转移守恒计算n(NO),然后计算出标况下一氧化氮的体积.
解答:
解:将镁和铜组成的混合物加入到稀HNO3中,金属完全溶解(假设反应中还原产物只有NO),发生反应:3Mg+8HNO3(稀)=3Mg(NO3)2+2NO↑+4H2O、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,向反应后的溶液中加入过量的3mol/L NaOH溶液至沉淀完全,发生反应:Mg(NO3)2+2NaOH=Mg(OH)2↓+2NaNO3、Cu(NO3)2+2NaOH=Cu(OH)2↓+2NaNO3,沉淀为氢氧化镁和氢氧化铜,生成沉淀的质量比原合金的质量增加5.1g,则氢氧化镁和氢氧化铜含有氢氧根的质量为5.1g,氢氧根的物质的量为:n(OH-)=
=0.3mol,根据反应方程式可知,镁和铜的总的物质的量为:n=
×n(OH-)=0.15mol,
A.根据反应方程式Mg(NO3)2+2NaOH=Mg(OH)2↓+2NaNO3、Cu(NO3)2+2NaOH=Cu(OH)2↓+2NaNO3可知,镁和铜的总的物质的量为铜离子物质的量的一半,即:
=0.15mol,假定全为镁,金属质量为0.15mol×24g/mol=3.6g,若全为铜,金属质量为:0.15mol×64g/mol=9.6g,所以参加反应的金属的总质量(m)范围为:3.6g<m<9.6g,则金属质量可能为6.4g,故A错误;
B.根据方程式可知参加反应的n反应(HNO3)=
n(金属)=
×0.15mol=0.4mol,故B错误;
C.反应消耗氢氧化钠的物质的量为:n(NaOH)=n(OH-)=0.3mol,则加入的氢氧化钠溶液的体积为:V=
=0.1L=100mL,故C错误;
D.金属的物质的量为0.15mol,完全反应失去0.15mol×2=0.3mol电子,根据电子转移守恒,生成一氧化氮的物质的量为:n(NO)=
=0.1mol,标准状况下0.1molNO的体积为2.24L,故D正确;
故选D.
| 5.1g |
| 17g/mol |
| 1 |
| 2 |
A.根据反应方程式Mg(NO3)2+2NaOH=Mg(OH)2↓+2NaNO3、Cu(NO3)2+2NaOH=Cu(OH)2↓+2NaNO3可知,镁和铜的总的物质的量为铜离子物质的量的一半,即:
| 0.3mol |
| 2 |
B.根据方程式可知参加反应的n反应(HNO3)=
| 8 |
| 3 |
| 8 |
| 3 |
C.反应消耗氢氧化钠的物质的量为:n(NaOH)=n(OH-)=0.3mol,则加入的氢氧化钠溶液的体积为:V=
| 0.3mol |
| 3mol/L |
D.金属的物质的量为0.15mol,完全反应失去0.15mol×2=0.3mol电子,根据电子转移守恒,生成一氧化氮的物质的量为:n(NO)=
| 0.3mol |
| 5-2 |
故选D.
点评:本题主要考查混合物有关计算,涉及镁铜与硝酸反应、生成的盐与氢氧化钠反应,侧重于学生的得失电子守恒、质量守恒等综合运用和解决复杂问题的能力的考查,是一道考查能力的好题,难度中等.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
两种气态烃的混合气体共1L,在空气中燃烧生成1.5L CO2气体和2L水蒸气(气体体积均在相同状况下测定),关于该混合气体的说法不正确的是( )
| A、一定含有甲烷 |
| B、可能有乙烯 |
| C、一定含有乙烷,不一定含有甲烷 |
| D、一定不含有乙烷 |
下列说法正确的是( )
| A、室温下,pH为11的氨水与pH为3的盐酸等体积混合,溶液呈中性 |
| B、在0.1 mol/L(NH4)2Fe(SO4)2溶液中:c(H+)+c(NH4+)+c(Fe2+)═c(OH-)+c(SO42-) |
| C、向醋酸溶液中加入适量醋酸钠,所得酸性溶液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D、0.2mo1?L-1的Na2CO3溶液:c(OH-)═c(HCO3-)+c(H+)+2c(H2CO3) |
PM2.5细颗粒物含有的毒性物质来源之一是汽车尾气排放.通过排气管加装催化装置,可有效减少CO和NO的排放,催化装置内发生的反应为:NOx+CO
N2+CO2,下列关于此反应的说法中,不正确的是( )
| 催化剂 |
| A、所涉及元素中原子半径:C>N>O |
| B、等物质的量N2和CO2中,共价键的个数比为3:4 |
| C、氧化剂与还原剂的物质的量之比为1:1时,NOx中氮元素的化合价为+2价 |
| D、当x=2时,每生成1mol N2,转移电子数为4mol |

 烯烃分子在一定条件下会发生二分子聚合,其实质是一个分子中饱和碳原子上的一个C-H键断裂,对另一个分子中的双键进行加成.也可以烯烃复分解反应.如:
烯烃分子在一定条件下会发生二分子聚合,其实质是一个分子中饱和碳原子上的一个C-H键断裂,对另一个分子中的双键进行加成.也可以烯烃复分解反应.如:
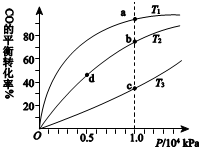 用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g)?CH3OH(g)△H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如右下图所示.下列说法正确的是( )
用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g)?CH3OH(g)△H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如右下图所示.下列说法正确的是( )  1L某混合溶液中可能含有的离子如下表:
1L某混合溶液中可能含有的离子如下表: