题目内容
捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用.目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)?(NH4)2CO3(aq)△H1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g)?NH4HCO3(aq)△H2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)?2NH4HCO3(aq)△H3
请回答下列问题:
(1)△H3与△H1、△H2之间的关系是:△H3= .
(2)反应Ⅲ的化学平衡常数表达式为 .
(3)为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),在t时刻,测得容器中CO2气体的浓度.然后分别在温度为T2、T3、T4、T5下,保持其他初始实验条件不变,重复上述实验,经过相同时间测得CO2气体浓度,得到趋势图(见图1).则:
①△H3 0(填“>”、“=”或“<”).
②在T1~T2及T4~T5两个温度区间,容器内CO2气体浓度呈现如图1所示的变化趋势,其原因是 .
③反应Ⅲ在温度为T1时,溶液pH随时间变化的趋势曲线如图2所示.当时间到达t1时,将该反应体系温度迅速上升到T2,并维持该温度.请在该图中画出t1时刻后溶液的pH变化总趋势曲线.

(4)利用反应Ⅲ捕获CO2,在(NH4)2CO3初始浓度和体积确定的情况下,提高CO2吸收量的措施有
(5)下列物质中也可以作为CO2捕获剂的是 .
A.NH4Cl B.Na2CO3 C.HOCH2CH2OH D.HOCH2CH2NH2.
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)?(NH4)2CO3(aq)△H1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g)?NH4HCO3(aq)△H2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)?2NH4HCO3(aq)△H3
请回答下列问题:
(1)△H3与△H1、△H2之间的关系是:△H3=
(2)反应Ⅲ的化学平衡常数表达式为
(3)为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),在t时刻,测得容器中CO2气体的浓度.然后分别在温度为T2、T3、T4、T5下,保持其他初始实验条件不变,重复上述实验,经过相同时间测得CO2气体浓度,得到趋势图(见图1).则:
①△H3
②在T1~T2及T4~T5两个温度区间,容器内CO2气体浓度呈现如图1所示的变化趋势,其原因是
③反应Ⅲ在温度为T1时,溶液pH随时间变化的趋势曲线如图2所示.当时间到达t1时,将该反应体系温度迅速上升到T2,并维持该温度.请在该图中画出t1时刻后溶液的pH变化总趋势曲线.

(4)利用反应Ⅲ捕获CO2,在(NH4)2CO3初始浓度和体积确定的情况下,提高CO2吸收量的措施有
(5)下列物质中也可以作为CO2捕获剂的是
A.NH4Cl B.Na2CO3 C.HOCH2CH2OH D.HOCH2CH2NH2.
考点:热化学方程式,化学平衡常数的含义,化学平衡的影响因素,物质的量或浓度随时间的变化曲线
专题:基本概念与基本理论
分析:(1)根据盖斯定律来确定焓变值间的关系;
(2)平衡常数等于产物平衡浓度系数次幂之积和反应物平衡浓度系数次幂之积的比值;
(3)①根据温度升高,反应向着吸热方向进行,反之,向着放热方向进行来判断;
②根据影响化学反应速率的因素来回答;
③温度迅速上升到T2并维持温度不变,平衡逆向移动,溶液pH增大,在T2时又建立新的平衡,据此来作图即可;
(4)根据平衡移动原理,提高CO2吸收量,即使得平衡正向移动即可;
(5)二氧化碳是酸性氧化物,具有碱性的物质可以和其反应.
(2)平衡常数等于产物平衡浓度系数次幂之积和反应物平衡浓度系数次幂之积的比值;
(3)①根据温度升高,反应向着吸热方向进行,反之,向着放热方向进行来判断;
②根据影响化学反应速率的因素来回答;
③温度迅速上升到T2并维持温度不变,平衡逆向移动,溶液pH增大,在T2时又建立新的平衡,据此来作图即可;
(4)根据平衡移动原理,提高CO2吸收量,即使得平衡正向移动即可;
(5)二氧化碳是酸性氧化物,具有碱性的物质可以和其反应.
解答:
解:(1)将反应Ⅰ倒过来书写:(NH4)2CO3 (aq)?2NH3 (l)+H2O (l)+CO2 (g)△H1,
将反应Ⅱ×2:2NH3 (l)+2H2O (l)+2CO2 (g)?2NH4HCO3 (aq)2△H2,
得:(NH4)2CO3 (aq)+H2O (l)+CO2 (g)?2NH4HCO3 (aq)△H3=2△H2-△H1.
故答案为:2△H2-△H1;
(2)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,因此反应Ⅲ的化学平衡常数表达式为K=
,故答案为:
;
(3)①由图1可知:在温度为T3时反应达平衡,此后温度升高,c(CO2)增大,平衡逆向移动,说明反应Ⅲ是放热反应△H3<0,故答案为:<;
②T1~T2区间,化学反应未达到平衡,温度越高,化学反应速率越快,所以CO2被捕获的量随温度升高而提高.T4~T5区间,化学反应已达到平衡,由于正反应是放热反应,温度升高平衡向逆反应方向移动,所以不利于CO2捕获,
故答案为:T1~T2区间,化学反应未达到平衡,温度越高,化学反应速率越快,所以CO2被捕获的量随温度升高而提高.T4~T5区间,化学反应已达到平衡,由于正反应是放热反应,温度升高平衡向逆反应方向移动,所以不利于CO2捕获;
③反应Ⅲ在温度为T1时建立平衡后(由图2可知:溶液pH不随时间变化而变化),迅速上升到T2并维持温度不变,平衡逆向移动,溶液pH增大,在T2时又建立新的平衡,图象应为 ,故答案为:
,故答案为: ;
;
(4)根据平衡移动原理,提高CO2吸收量,即使得平衡正向移动即可,可以降低温度或增大c(CO2),故答案为:降低温度或增大c(CO2);
(5)二氧化碳是酸性氧化物,具有碱性的物质均能捕获CO2,反应如下:Na2CO3+CO2+H2O=2NaHCO3,HOCH2CH2NH2+CO2+H2O=HOCH2CH2NH3++HCO3-,故答案为:BD.
将反应Ⅱ×2:2NH3 (l)+2H2O (l)+2CO2 (g)?2NH4HCO3 (aq)2△H2,
得:(NH4)2CO3 (aq)+H2O (l)+CO2 (g)?2NH4HCO3 (aq)△H3=2△H2-△H1.
故答案为:2△H2-△H1;
(2)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,因此反应Ⅲ的化学平衡常数表达式为K=
| c2(NH4HCO3) |
| c[(NH4)2CO3]?c(CO2) |
| c2(NH4HCO3) |
| c[(NH4)2CO3]?c(CO2) |
(3)①由图1可知:在温度为T3时反应达平衡,此后温度升高,c(CO2)增大,平衡逆向移动,说明反应Ⅲ是放热反应△H3<0,故答案为:<;
②T1~T2区间,化学反应未达到平衡,温度越高,化学反应速率越快,所以CO2被捕获的量随温度升高而提高.T4~T5区间,化学反应已达到平衡,由于正反应是放热反应,温度升高平衡向逆反应方向移动,所以不利于CO2捕获,
故答案为:T1~T2区间,化学反应未达到平衡,温度越高,化学反应速率越快,所以CO2被捕获的量随温度升高而提高.T4~T5区间,化学反应已达到平衡,由于正反应是放热反应,温度升高平衡向逆反应方向移动,所以不利于CO2捕获;
③反应Ⅲ在温度为T1时建立平衡后(由图2可知:溶液pH不随时间变化而变化),迅速上升到T2并维持温度不变,平衡逆向移动,溶液pH增大,在T2时又建立新的平衡,图象应为
 ,故答案为:
,故答案为: ;
;(4)根据平衡移动原理,提高CO2吸收量,即使得平衡正向移动即可,可以降低温度或增大c(CO2),故答案为:降低温度或增大c(CO2);
(5)二氧化碳是酸性氧化物,具有碱性的物质均能捕获CO2,反应如下:Na2CO3+CO2+H2O=2NaHCO3,HOCH2CH2NH2+CO2+H2O=HOCH2CH2NH3++HCO3-,故答案为:BD.
点评:本题考查热化学方程式书写、化学反应速率、化学平衡移动和化学方程式书写等知识,注意知识的迁移和应用是关键,难度大.

练习册系列答案
相关题目
NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、常温常压下,92g NO2和N2O4的混合气体中含有的原子数与92g NO2所含有的原子数不同 |
| B、同温常压下,相同体积的任何气体中均含有相同的原子数 |
| C、在常温常压下,相同质量的O2和O3具有相同的原子数目 |
| D、1L 1mol/L CH3COONa溶液中含CH3COO-的数目为NA |
 如图中,图1为甲烷和O2构成的燃料电池,图2为电解MgCl2溶液的装置.用该装置进行实验,反应开始后,观察到x电极附近出现白色沉淀.下列说法正确的是( )
如图中,图1为甲烷和O2构成的燃料电池,图2为电解MgCl2溶液的装置.用该装置进行实验,反应开始后,观察到x电极附近出现白色沉淀.下列说法正确的是( )| A、A处通入的气体为O2,B处通入的气体为CH4 |
| B、电池内部K+向b极移动,OH-向a极移动 |
| C、图1装置中发生的总反应为CH4+2O2═CO2+2H2O |
| D、图1、图2中电解质溶液的pH均增大 |
两种气态烃的混合气体共1L,在空气中燃烧生成1.5L CO2气体和2L水蒸气(气体体积均在相同状况下测定),关于该混合气体的说法不正确的是( )
| A、一定含有甲烷 |
| B、可能有乙烯 |
| C、一定含有乙烷,不一定含有甲烷 |
| D、一定不含有乙烷 |
下列说法正确的是( )
| A、室温下,pH为11的氨水与pH为3的盐酸等体积混合,溶液呈中性 |
| B、在0.1 mol/L(NH4)2Fe(SO4)2溶液中:c(H+)+c(NH4+)+c(Fe2+)═c(OH-)+c(SO42-) |
| C、向醋酸溶液中加入适量醋酸钠,所得酸性溶液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D、0.2mo1?L-1的Na2CO3溶液:c(OH-)═c(HCO3-)+c(H+)+2c(H2CO3) |
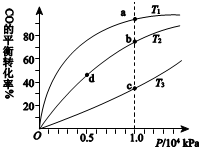 用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g)?CH3OH(g)△H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如右下图所示.下列说法正确的是( )
用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g)?CH3OH(g)△H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如右下图所示.下列说法正确的是( )