题目内容
3.关于常温下pH=2的醋酸,下列叙述正确的是( )| A. | c(CH3COOH)=0.01 mol•L-1 | |
| B. | c(H+)=c(CH3COO-) | |
| C. | 加水稀释100倍后,溶液pH=4 | |
| D. | 加入CH3COONa固体,可抑制CH3COOH的电离 |
分析 醋酸为弱电解质,醋酸的电离平衡:CH3COOH?CH3COO-+H+,加水稀释促进醋酸的电离,加入少量CH3COONa固体,c(CH3COO-)增大,平衡逆向移动,以此解答该题.
解答 解:A.醋酸为弱电解质,醋酸部分电离,所以醋酸的浓度大于电离出来的氢离子的浓度,即c(CH3COOH)>0.01mol•L-1,故A错误;
B.根据溶液中电荷守恒可知:c(H+)=c(CH3COO-)+c(OH-),故B错误;
C.加水稀释100倍后,加水稀释促进醋酸的电离,氢离子的物质的量增大,所以PH变化小于2个单位,即PH<4,故C错误;
D.加入少量CH3COONa固体,c(CH3COO-)增大,平衡逆向移动,可抑制醋酸的电离,故D正确.
故选D.
点评 本题考查了弱电解质的电离,酸碱混合的定性判断以及溶液中的电荷守恒,侧重于学生的分析能力的考查,题目难度不大.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
8.下列有关混合物的分离方法中,正确的是( )
| A. | 从食盐溶液中获得食盐晶体采用蒸馏的方法 | |
| B. | 将碘晶体中含有的少量沙子除去采用蒸馏的方法 | |
| C. | 除去酒精中含有的较多量水采用蒸馏的方法 | |
| D. | 从碘水中获得碘的晶体采用过滤的方法 |
9.某学生用量筒量取液体,量筒放平稳后仰视液面读得数值为 19mL,倾倒部分液体后,又俯视液面,读得数值为10mL. 则该学生实际倾倒的液体体积是( )
| A. | 9mL | B. | 小于9mL | ||
| C. | 大于9 mL | D. | 因操作错误无法判断 |
18.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1mol苯乙烯(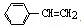 )中含有的C=C数为4NA )中含有的C=C数为4NA | |
| B. | 标准状况下,2.24L己烷含有的分子数为0.1NA | |
| C. | 1mol甲基含10NA个电子 | |
| D. | 某温度下,2.6g乙炔和苯的混合气体中所含碳原子数为0.2NA |
8.下列过程涉及氧化还原反应的是( )
| A. | 氨气通入水中能得NH3•H2O | B. | 实验室用大理石与盐酸制取CO2 | ||
| C. | 久置的铁钉生锈 | D. | 蒸馏法将海水淡化为饮用水 |
13. 用中和滴定法测定某盐酸的物质的量浓度.
用中和滴定法测定某盐酸的物质的量浓度.
(1)标准溶液应盛于A(填“A”或“B”)滴定管中.
(2)若选用酚酞作指示剂,以0.125 0mol•L-1的标准氢氧化钠溶液滴定,如何判断滴定终点当加入最后一滴标准液时,溶液恰好出现红色且半分钟内红色不褪去
(3)实验数据记录如表,请分析数据并计算,盐酸的物质的量浓度=0.1250mol•L-1
 用中和滴定法测定某盐酸的物质的量浓度.
用中和滴定法测定某盐酸的物质的量浓度.(1)标准溶液应盛于A(填“A”或“B”)滴定管中.
(2)若选用酚酞作指示剂,以0.125 0mol•L-1的标准氢氧化钠溶液滴定,如何判断滴定终点当加入最后一滴标准液时,溶液恰好出现红色且半分钟内红色不褪去
(3)实验数据记录如表,请分析数据并计算,盐酸的物质的量浓度=0.1250mol•L-1
| 滴定次数 | 待测液体体积/mL | 标准碱液 | |
| 滴定前读数/mL | 滴定后读数/mL | ||
| ① | 20.0 | 0.40 | 20.41 |
| ② | 20.0 | 0.10 | 20.60 |
| ③ | 20.0 | 4.00 | 23.99 |
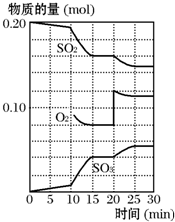 在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)?2SO3(g);△H<0.
在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)?2SO3(g);△H<0.