题目内容
9.化学在生产和生活中有着重要的应用,下列叙述中正确的是( )| A. | 漂白粉既可作纸张的漂白剂,又可用作游泳池的消毒剂 | |
| B. | 汽车尾气中含有氮的氧化物,是由汽油不完全燃烧造成的 | |
| C. | 氧化铝、氢氧化钠、碳酸氢钠都是常见的胃酸中和剂 | |
| D. | 工业上,焦炭在高温下还原二氧化硅得到粗硅,说明碳的金属性比硅的强 |
分析 A.次氯酸钙具有强氧化性,能杀菌消毒,且具有漂白性;
B.汽油中不含氮元素;
C.氢氧化钠为强碱,具有强烈的腐蚀性;
D.根据单质之间的置换反应可以确定还原性的强弱.
解答 解:A.次氯酸钙具有强氧化性,能使蛋白质变性而杀菌消毒,同时也具有漂白性,所以漂白粉既可做漂白棉麻纸张的漂白剂,又可做游泳池及环境的消毒剂,故A正确;
B.汽油中不含氮元素,汽车尾气中的氮氧化物是空气中的氮气与氧气在高温下生成的,故B错误;
C.氢氧化钠为强碱,具有强烈的腐蚀性,能够腐蚀皮肤,不能用于治疗胃酸过多,故C错误;
D.工业上,焦炭在高温下还原二氧化硅得到粗硅和一氧化碳,根据元素周期律知识,还原性C<Si,故D错误.
故选A.
点评 本题考查化学在生产生活中的应用,熟悉相关物质的性质是解题关键,题目难度不大,注意对知识的积累.

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目
17.下列醇类物质中不能发生消去反应的是( )
| A. | 乙醇 | B. | 1-丙醇 | ||
| C. | 2,2-二甲基-1-丙醇 | D. | 1-丁醇 |
20.下列有关说法中,正确的是( )
| A. | 焰火的五彩缤纷是某些金属元素化学性质的体现 | |
| B. | 高纯度的单晶硅用于制造登月车的光电池和光导纤维 | |
| C. | 可溶性铜盐有毒,但在生命体中,铜是一种不可缺少的微量元素 | |
| D. | 用明矾可以将自来水净化成纯净水 |
17.乙烷燃料电池的原理如图所示,下列说法正确的是( )
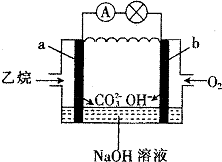

| A. | a为负极,电极反应式为CH3CH3-14e-+18OH-═2CO32-+12H2O | |
| B. | 电子从a极经导线移向b极,再经溶液移向a极 | |
| C. | 电池工作一段时间后电解质溶液的pH增大 | |
| D. | 用该电池电解硫酸铜溶液(电解池的电极为惰性电极),消耗氧气的物质的量与析出铜的物质的量之比为2:1 |
4.用NA表示阿伏德罗常数,下列叙述正确的是( )
| A. | 标准状况下,22.4L H2O含有的分子数为 NA | |
| B. | 通常状况下,NA 个CO2分子占有的体积为22.4L | |
| C. | 将等物质的量的SO3和SO2溶于水,所得溶液中H+数目相等 | |
| D. | 常温常压下,1.06g Na2CO3溶于水形成的溶液中含有Na+离子数为0.02 NA |
19.下列有关物质检验的实验结论正确的是( )
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有SO42- |
| B | 向某溶液中加入2滴KSCN溶液不显红色.再向溶液中加入几滴新制氯水,溶液变为红色. | 该溶液中一定含有 Fe2+ |
| C | 将某气体通入到品红溶液中,品红褪色 | 该气体一定为SO2 |
| D | 向某溶液中滴入盐酸,产生能使澄清石灰水变浑浊的无色无味气体 | 该溶液中一定含有CO32- |
| A. | A | B. | B | C. | C | D. | D |


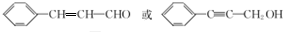 .
. (填结构简式).
(填结构简式).