题目内容
3.实验室模拟用工业废弃固体(含有Cu2S、Fe2O3、SiO2等)制取粗铜、绿矾(FeSO4•7H2O)的操作流程如下: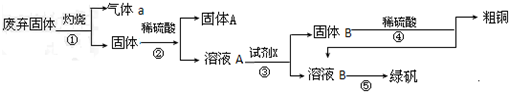
(1)固体A中一定含有的物质是SiO2(填化学式);
(2)试剂X是Fe,试剂X与溶液A反应得到固体B和溶液B的离子方程式有 2 Fe3++Fe=3Fe2+、Fe+Cu2+=Fe2++Cu;
(3)溶液B获得绿矾的实验操作是蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
分析 废弃固体主要成分Cu2S和Fe2O3、SiO2等,灼烧废气固体发生反应Cu2S+2O2$\frac{\underline{\;高温\;}}{\;}$SO2+2CuO,所以气体a是SO2,固体A是CuO和Fe2O3、SiO2,固体和稀硫酸混合,发生的反应为CuO+H2SO4=CuSO4+H2O、Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,所以溶液A中成分为CuSO4、Fe2(SO4)3,而二氧化硅与稀硫酸不反应,则固体A为SiO2,向溶液A中加入过量Fe屑,发生反应CuSO4+Fe=FeSO4+Cu、2Fe2(SO4)3+Fe=3FeSO4,所以固体B成分是Fe、Cu,滤液B成分为FeSO4,固体B和稀硫酸混合,Fe和稀硫酸反应生成FeSO4,Cu和稀硫酸不反应,过滤得到固体粗铜,以此解答该题.
解答 解:废弃固体主要成分Cu2S和Fe2O3、SiO2等,灼烧废气固体发生反应Cu2S+2O2$\frac{\underline{\;高温\;}}{\;}$SO2+2CuO,所以气体a是SO2,固体A是CuO和Fe2O3、SiO2,固体和稀硫酸混合,发生的反应为CuO+H2SO4=CuSO4+H2O、Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,所以溶液A中成分为CuSO4、Fe2(SO4)3,而二氧化硅与稀硫酸不反应,则固体A为SiO2,向溶液A中加入过量Fe屑,发生反应CuSO4+Fe=FeSO4+Cu、2Fe2(SO4)3+Fe=3FeSO4,所以固体B成分是Fe、Cu,滤液B成分为FeSO4,固体B和稀硫酸混合,Fe和稀硫酸反应生成FeSO4,Cu和稀硫酸不反应,过滤得到固体粗铜,
(1)由以上分析可知,二氧化硅和稀硫酸不反应,固体A为SiO2,故答案为:SiO2;
(2)加入试剂X,用于置换出铜并生成硫酸亚铁,则X应为Fe,发生的离子反应为2 Fe3++Fe=3Fe2+、Fe+Cu2+=Fe2++Cu,
故答案为:Fe;2 Fe3++Fe=3Fe2+、Fe+Cu2+=Fe2++Cu;
(3)溶液B获得绿矾的实验操作是蒸发浓缩、冷却结晶、过滤、洗涤、干燥,故答案为:冷却结晶;过滤.
点评 本题考查混合物的分离和提纯和制备,侧重考查学生分析问题、实验操作、思维缜密性等能力,明确物质的性质是解本题关键,能从整体上分析各个步骤发生的反应,能正确书写相应的化学方程式和离子方程式,题目难度中等.

| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
| A. | 在水中通入氯气:Cl2+H2O=Cl-+2H++ClO- | |
| B. | 二氧化硅与烧碱溶液反应:SiO2+2OH-=SiO32-+H2O | |
| C. | 往氯化铝溶液中滴加过量的氨水:Al3++4NH3•H2O=[Al(OH)4]-+4NH4+ | |
| D. | 往氯化铁溶液中加入铜:Fe3++Cu=Cu2++Fe2+ |
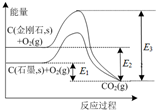
| A. | 石墨与O2生成CO2的反应是吸热反应 | |
| B. | 等量金刚石和石墨完全燃烧,金刚石放出热量更多 | |
| C. | 从能量角度看,金刚石比石墨更稳定 | |
| D. | 金刚石转化为石墨需要吸收的能量为E3-E2 |
| A. | 氯碱工业 | B. | 高炉炼铁 | C. | 粗硅提纯 | D. | 硫酸工业 |
 .该物质合成线路如图示:
.该物质合成线路如图示: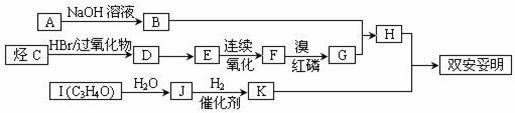
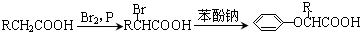
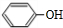 ,CC(CH3)2=CH2,ICH2=CH-CHO,JHOCH2CH2CHO.
,CC(CH3)2=CH2,ICH2=CH-CHO,JHOCH2CH2CHO.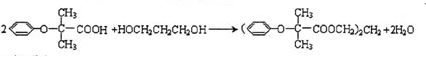 .
. .
.