题目内容
3.某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,取a g的A在一定条件下可实现如图所示的物质之间的变化.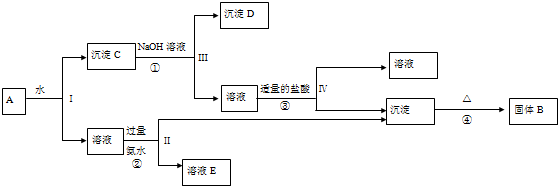
(1)Ⅰ、Ⅱ、Ⅲ、Ⅳ四步的实验操作方法为过滤.
(2)沉淀D的化学式为Fe2O3
(3)①的离子方程式为Al2O3+2OH-=2AlO2-+H2O
②的离子方程式为Al3++3NH3﹒H2O=Al(OH)3↓+3NH4+
(4)为使Al元素全部转化为B,步骤③的缺陷为盐酸的量不易控制,改进的方法为通入CO2
(5)B的质量为b g,则混合物A中Al元素的质量分数为$\frac{9b}{17a}×100%$(用含a,b的代数式表示)
分析 某混合物A含有KAl(SO4)2、Al2O3和Fe2O3,加水后经过滤分离可得溶液KAl(SO4)2和Al2O3、Fe2O3沉淀混合物C,加入NaOH溶液,NaOH和Al2O3反应生成NaAlO2,过滤后得到NaAlO2溶液,沉淀D为Fe2O3,加入盐酸得到FeCl3,NaAlO2溶液中加入适量盐酸,反应生成Al(OH)3和NaCl,Al(OH)3加热分解生成B为Al2O3,溶液E为K2SO4和(NH4)2SO4混合物,结合对应的物质的性质以及题目要求解答该题.
解答 解:某混合物A含有KAl(SO4)2、Al2O3和Fe2O3,加水后经过滤分离可得溶液KAl(SO4)2和Al2O3、Fe2O3沉淀混合物C,加入NaOH溶液,NaOH和Al2O3反应生成NaAlO2,过滤后得到NaAlO2溶液,沉淀D为Fe2O3,加入盐酸得到FeCl3,NaAlO2溶液中加入适量盐酸,反应生成Al(OH)3和NaCl,Al(OH)3加热分解生成B为Al2O3,溶液E为K2SO4和(NH4)2SO4混合物,
(1)Ⅰ、Ⅱ、Ⅲ、Ⅳ四步的实验操作用于分离溶液和沉淀,为过滤操作,故答案为:过滤;
(2)通过以上分析知,D是Fe2O3,故答案为:Fe2O3;
(3)反应①为氧化铝和氢氧化钠的反应,生成偏铝酸钠和水,离子方程式为Al2O3+2OH-=2AlO2-+H2O;
反应②为铝离子和一水合氨的反应,生成铵盐和氢氧化铝沉淀,离子方程式为Al3++3NH3﹒H2O=Al(OH)3↓+3NH4+,
故答案为:Al2O3+2OH-=2AlO2-+H2O;Al3++3NH3﹒H2O=Al(OH)3↓+3NH4+;
(4)氢氧化铝能溶于稀盐酸,所以盐酸的量不易控制,要想得到氢氧化铝沉淀,最好是向偏铝酸钠溶液中通入CO2,二氧化碳和偏铝酸钠反应生成碳酸钠或碳酸氢钠和氢氧化铝,
故答案为:盐酸的量不易控制;通入CO2;
(5)B为Al2O3,bg氧化铝来自于KAl(SO4)2、Al2O3,则样品中Al元素质量为$\frac{54b}{102}$g,可知混合物A中Al元素的质量分数为$\frac{\frac{54b}{102}}{a}×100%$=$\frac{9b}{17a}×100%$,
故答案为:$\frac{9b}{17a}×100%$.
点评 本题考查无机物的推断,为高频考点,综合考查元素化合物性质,侧重Al、Fe及其化合物性质的考查,注意氧化铝的两性,明确发生的化学反应为解答的关键,题目难度中等.

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案| A. | BaCl2 | B. | Ba(NO3)2 | C. | FeCl3 | D. | 盐酸 |
| A. | 标准状况下,1molHCl | B. | 常温常压下,48gO3 | ||
| C. | 标准状况下33.6LNH3 | D. | 2NA个CH4 |
| A. | Na2CO3→NaOH | B. | BaCl2→Ba(OH)2 | C. | FeCl3→Fe(OH)3 | D. | CaCO3→CaCl2 |
| A. | 低温、低压 | B. | 低温、高压 | C. | 高温、高压 | D. | 高温、低压 |
| A. | Na+ | B. | Al3+ | C. | Fe3+ | D. | Fe2+ |
| A. | 由NO2和N2O4组成的平衡体系加压后颜色先变深后变浅 | |
| B. | 增大压强可加快SO2转化为SO3的速率 | |
| C. | 黄绿色的氯水光照后颜色变浅 | |
| D. | 在含有Fe(SCN)3的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去 |
| X | Y | |
| Z | W | |
| T |
| A. | 氢化物稳定性Y比W强,是因为Y的氢化物中存在氢键 | |
| B. | XY2、XW2、ZY2熔沸点依次增大,都是由共价键形成的分子晶体 | |
| C. | 一定条件下,X单质能与ZY2反应生成Z单质,说明X的非金属性比Z强 | |
| D. | 根据元素周期律,可以推测T元素的单质具有半导体特性,钠能与T形成Na2T2化合物 |
