题目内容
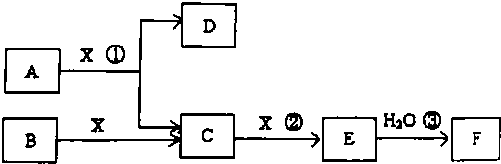
3.从海水中提取金属镁,没有涉及到的化学反应是( )电解.
| A. | Mg2++2OH-═Mg(OH)2↓ | B. | Mg(OH)2+2H+═2Mg2++2H2O | ||
| C. | Mg(OH)2═MgO+H2O | D. | MgCl2═Mg+Cl2↑ |
分析 从海水中提取金属镁的流程为:先将海水中含有的镁离子转化为氢氧化镁沉淀,然后将氢氧化镁溶于盐酸中得到氯化镁溶液,用氯化镁溶液制取无水氯化镁,最后利用电解熔融氯化镁的方法冶炼镁.
解答 解:从海水中提取金属镁的流程为:
先将海水中含有的镁离子转化为氢氧化镁沉淀,反应方程式为:Mg2++2OH-=Mg(OH)2↓,
然后将氢氧化镁溶于盐酸中得到氯化镁溶液,反应方程式为:Mg(OH)2+2HCl=MgCl2+2H2O,
用氯化镁溶液在氯化氢氛围中制取无水氯化镁,活泼金属采用电解其熔融盐的方法冶炼,镁是活泼金属,所以最后利用电解熔融氯化镁的方法冶炼镁,反应方程式为MgCl2$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑,所以没有涉及的方程式是氢氧化镁的分解.
故选C.
点评 本题考查了物质的性质和变化,知晓从海水中提取金属镁的流程,明确物质发生的变化及物质间的反应是解本题关键,难度不大.

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
13.室温时,M(OH)2(s)═M2+(aq)+2OH-(aq) Ksp=a;c(M2+)=b mol•L-1时,溶液的pH等于( )
| A. | $\frac{1}{2}$lg($\frac{b}{a}$) | B. | $\frac{1}{2}$lg($\frac{a}{b}$) | C. | 14+$\frac{1}{2}$lg($\frac{a}{b}$) | D. | 14+$\frac{1}{2}$lg($\frac{b}{a}$) |
11.四种常见元素的性质或结构信息如表所示,请问答下列问题.
(1)R的基态原子价层电子排布式为3d104s1,A、B、D这三种元素的第一电离能由大到小的顺序为N>C>Si(写元素符号).
(2)A、B,D均可形成多种氢化物,在最常见的三种氢化物中,分子构型为三角锥的氢化物分子式为NH3,任意写出一种中心原子存在sp2、sp3两种杂化类型的物质的结构简式CH2=CH-CH3,与A的常见单质互为等电子体的上述元素的氧化物是CO.
(3)B、D均可形成氧化物,等物质的量的B、D的最高价氧化物中σ键之比为2:1,已知有下列两种数据:
两种氧化物熔点、沸点差异过大,请用键能大小解释CO2是分子晶体,熔点、沸点高低是由比较微弱的范德华力决定的而与化学键强弱无关,SiO2属原子晶体,其熔点、沸点高低是由强大的共价键决定的.
(4)在一定条件下,Cl-与R2+可形成一种无限长链离 ,研究表明该离子中每个氯原子最外层均达到8电子稳定结构,有些氯与R之间存在配位键,若该长链离子中含有n个R,则该离子的化学式为$(CuC{l}_{3}{)_{n}}^{n-}$.
,研究表明该离子中每个氯原子最外层均达到8电子稳定结构,有些氯与R之间存在配位键,若该长链离子中含有n个R,则该离子的化学式为$(CuC{l}_{3}{)_{n}}^{n-}$.
(5)A元素能形成组成为Pt(AH3)2Cl2 的配合物,该配合物存在两种同分异构体:一种为淡黄色(Q),不具有抗癌作用,在水中的溶解度小;另一种为黄绿色(P),具有抗癌作用,在水中的溶解度较大.
①Q是非极性分子(填“极性”或“非极性”)分子,
②P的结构简式为 ( AH3配体作为一个整体写).
( AH3配体作为一个整体写).
| 元素 | A | B | R | D |
| 相关信息 | 基态原子核外电子占据3个能级且最高能级上有3个电子 | B的单质是最常见半导体材料 | 位于第四周期I B族 | 是非金属元素,其形成的某种单质是电的良导体,有的分子形状似足球 |
(2)A、B,D均可形成多种氢化物,在最常见的三种氢化物中,分子构型为三角锥的氢化物分子式为NH3,任意写出一种中心原子存在sp2、sp3两种杂化类型的物质的结构简式CH2=CH-CH3,与A的常见单质互为等电子体的上述元素的氧化物是CO.
(3)B、D均可形成氧化物,等物质的量的B、D的最高价氧化物中σ键之比为2:1,已知有下列两种数据:
| 键能(kJ/mol) | 熔点(K) | 沸点(K) | |
| BO2 | B-O:452 | 1923 | 2503 |
| DO2 | D=O:615,D-O:348 | 216 | 195 |
(4)在一定条件下,Cl-与R2+可形成一种无限长链离
 ,研究表明该离子中每个氯原子最外层均达到8电子稳定结构,有些氯与R之间存在配位键,若该长链离子中含有n个R,则该离子的化学式为$(CuC{l}_{3}{)_{n}}^{n-}$.
,研究表明该离子中每个氯原子最外层均达到8电子稳定结构,有些氯与R之间存在配位键,若该长链离子中含有n个R,则该离子的化学式为$(CuC{l}_{3}{)_{n}}^{n-}$.(5)A元素能形成组成为Pt(AH3)2Cl2 的配合物,该配合物存在两种同分异构体:一种为淡黄色(Q),不具有抗癌作用,在水中的溶解度小;另一种为黄绿色(P),具有抗癌作用,在水中的溶解度较大.
①Q是非极性分子(填“极性”或“非极性”)分子,
②P的结构简式为
 ( AH3配体作为一个整体写).
( AH3配体作为一个整体写).
18.NA 为阿伏加德罗常数,下列叙述正确的是( )
| A. | 标准状况下,22.4LCl2完全溶于水时转移的电子数为NA | |
| B. | 1mol羟基(-OH)含有的电子数为9NA | |
| C. | 100g30%醋酸溶液中氢原子数为2NA | |
| D. | 100mL水中OH-的个数是10-8NA |
8.下列溶液中粒子的物质的量浓度关系正确的是( )
| A. | 0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) | |
| B. | 20mL 0.1mol/L CH3COONa溶液与10mL 0.1mol/L HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH4+)+c(OH-) | |
| D. | 0.1mol/L CH3COOH溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
15.有关氧化还原反应本质的叙述中,正确的是( )
| A. | 化合价升高 | B. | 失去电子或电子对偏离 | ||
| C. | 电子的得失或电子对的偏向 | D. | 化合价降低 |
12.生理盐水是指质量分数为0.9%的NaCl溶液.下列有关该溶液说法正确的是( )
| A. | 100g溶液中含有0.9g NaCl | B. | 100g水中含有0.9g NaCl | ||
| C. | 100g溶液中含有0.9mol NaCl | D. | 100g水中含有0.9mol NaCl |
 ;
;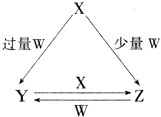 X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(水及部分产物已略去).
X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(水及部分产物已略去).