题目内容
环境监测测定水中溶解氧的方法是:
①量取25mL水样,迅速加入固定剂MnSO4溶液和碱性KI溶液(含KOH),立即塞好瓶塞,反复振荡,使之充分反应,其反应式为:2Mn2++O2+4OH-=2MnO(OH)2(该反应极快)
②测定:开塞后迅速加入1mL~2mL浓硫酸(提供H+),使之生成I2,再用0.1000mol/L的Na2S2O3溶液滴定(以淀粉为指示剂),消耗VmL.有关反应式为:MnO(OH)2+2I-+4H+=Mn2++I2+3H2O I2+2S2O32-=2I-+S4O62-
试回答:(1)消耗Na2S2O3的体积平均值为 ,水中溶解氧的量是(以g/L为单位,保留3位有效数字) .
(2)滴定(I2和S2O32-反应)以淀粉为指示剂,终点时溶液 .
(3)判断下列操作引起的误差(填“偏大”、“偏小”“无影响”或“无法判断”)
①读数:滴定前平视,滴定后俯视
②未用标准液润洗滴定管
③用固体配制Na2S2O3溶液时,其固体中含有对反应体系无影响的杂质
④待测液的滴定管之前有气泡,取液后无气泡 .
①量取25mL水样,迅速加入固定剂MnSO4溶液和碱性KI溶液(含KOH),立即塞好瓶塞,反复振荡,使之充分反应,其反应式为:2Mn2++O2+4OH-=2MnO(OH)2(该反应极快)
②测定:开塞后迅速加入1mL~2mL浓硫酸(提供H+),使之生成I2,再用0.1000mol/L的Na2S2O3溶液滴定(以淀粉为指示剂),消耗VmL.有关反应式为:MnO(OH)2+2I-+4H+=Mn2++I2+3H2O I2+2S2O32-=2I-+S4O62-
| 滴定次数 | 待测液的体积/mL | 0.1000mol?L-1 Na2S2O3的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
(2)滴定(I2和S2O32-反应)以淀粉为指示剂,终点时溶液
(3)判断下列操作引起的误差(填“偏大”、“偏小”“无影响”或“无法判断”)
①读数:滴定前平视,滴定后俯视
②未用标准液润洗滴定管
③用固体配制Na2S2O3溶液时,其固体中含有对反应体系无影响的杂质
④待测液的滴定管之前有气泡,取液后无气泡
考点:探究物质的组成或测量物质的含量
专题:
分析:(1)第2组数据误差较大,舍去,根据第1组和第3组数据计算Na2S2O3的体积平均值;根据关系式:O2~2MnO(OH)2~2I2~4S2O32-可计算水样中溶解氧的浓度;
(2)碘遇淀粉变蓝,若单质碘被还原完,则蓝色褪去;
(3)分析不当操作对V(标准)的影响,以此判断浓度的误差.
(2)碘遇淀粉变蓝,若单质碘被还原完,则蓝色褪去;
(3)分析不当操作对V(标准)的影响,以此判断浓度的误差.
解答:
解:(1)第2组数据误差较大,舍去,根据第1组和第3组数据计算Na2S2O3的体积平均值为:
mL=26.10mL;
根据反应:2Mn2++O2+4OH-═2MnO(OH)2,MnO(OH)2+2I-+4H+═Mn2-+I2+3H2O,I2+2S2O32-═S4O62-+2I-,可知关系式:
O2~2MnO(OH)2~2I2~4S2O32-
32g 4mol
m 0.1000mol/L×26.10mL×10-3L/mL
m=
=20.88×10-3g,则1L水样含氧气质量为:
=0.835g/L;
故答案为:26.10mL;0.835g/L;
(2)碘遇淀粉变蓝,若单质碘被还原完,则蓝色褪去,半分钟不恢复蓝色证明达到滴定终点;
故答案为:由蓝色变为无色,半分钟不变;
(3)①滴定前平视,滴定后俯视,则所用标准液读数偏小,由此计算结果偏小;故答案为:偏小;
②滴定时,滴定管经水洗,蒸馏水洗后加入滴定剂Na2S2O3溶液,标准液体被稀释,浓度变稀,造成V(标准)偏大,由此计算结果偏大,故答案为:偏大;
③用固体配制Na2S2O3溶液时,其固体中含有对反应体系无影响的杂质,标准液浓度低,所用标准液体积偏大,由此计算结果偏大,故答案为:偏大;
④待测液的滴定管之前有气泡,取液后无气泡,所取待测液体积偏小,所用标准液偏小,由此计算结果偏小;故答案为:偏小.
| 26.11+26.09 |
| 2 |
根据反应:2Mn2++O2+4OH-═2MnO(OH)2,MnO(OH)2+2I-+4H+═Mn2-+I2+3H2O,I2+2S2O32-═S4O62-+2I-,可知关系式:
O2~2MnO(OH)2~2I2~4S2O32-
32g 4mol
m 0.1000mol/L×26.10mL×10-3L/mL
m=
| 32g×0.1000mol/L×26.10mL×10-3L/mL |
| 4mol |
| 20.88×10-3g |
| 0.025L |
故答案为:26.10mL;0.835g/L;
(2)碘遇淀粉变蓝,若单质碘被还原完,则蓝色褪去,半分钟不恢复蓝色证明达到滴定终点;
故答案为:由蓝色变为无色,半分钟不变;
(3)①滴定前平视,滴定后俯视,则所用标准液读数偏小,由此计算结果偏小;故答案为:偏小;
②滴定时,滴定管经水洗,蒸馏水洗后加入滴定剂Na2S2O3溶液,标准液体被稀释,浓度变稀,造成V(标准)偏大,由此计算结果偏大,故答案为:偏大;
③用固体配制Na2S2O3溶液时,其固体中含有对反应体系无影响的杂质,标准液浓度低,所用标准液体积偏大,由此计算结果偏大,故答案为:偏大;
④待测液的滴定管之前有气泡,取液后无气泡,所取待测液体积偏小,所用标准液偏小,由此计算结果偏小;故答案为:偏小.
点评:本题考查了氧化还原滴定的操作、仪器、误差分析和数据处理,难度不大,注意实验的基本操作方法和注意事项.

练习册系列答案
相关题目
根据原电池形成的条件分析图所示的各装置,其中有电流通过的是( )
A、 乙醇 |
B、 稀硫酸 |
C、 |
D、 稀硫酸 |
烃分子中若含有双键,叁键或环,其碳原子所结合的氢原子则少于同碳原子数对应烷烃所含的氢原子数,亦具有一定的不饱和度(用Ω表示),下表列出几种烃的不饱和度:据此下列说法不正确的是:( )
| 有机物 | 乙烯 | 乙炔 | 环已烷 | 苯 |
| Ω | 1 | 2 | 1 | 4 |
| A、1molΩ=3的不饱和链烃再结合6molH2即达到饱和 |
| B、C10H8的Ω=7 |
| C、C4H8的不饱和度与C3H6、C2H4的不饱和度不相同 |
| D、CH3CH2CH=CH2与环丁烷的不饱和度相同 |
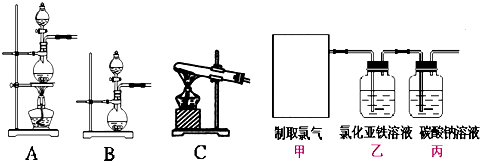
 某课外活动小组用题图探究铝镁合金的组成.
某课外活动小组用题图探究铝镁合金的组成.
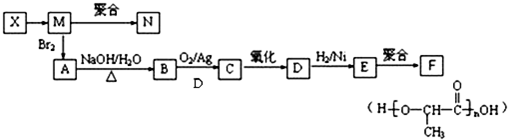
 水杨酸酯E为紫外线吸收剂,可用于配制防晒霜.E的一种合成路线如下:
水杨酸酯E为紫外线吸收剂,可用于配制防晒霜.E的一种合成路线如下: