题目内容
100ml 2mol?L-1稀盐酸与一定量的锌充分反应,锌全部溶解,生成的氢气在标准状况下体积为1.12L,设反应后溶液的体积仍为100mL,则反应后溶液中的H+物质的量浓度为多少?
考点:化学方程式的有关计算
专题:计算题
分析:金属锌可以和盐酸发生反应,根据生成氢气的量计算消耗的盐酸的物质的量,然后根据剩余的盐酸的量结合公式c=
计算氢离子的浓度.
| n |
| V |
解答:
解:设:金属锌和盐酸反应生成1.12L即
=0.05mol氢气消耗的盐酸的物质的量是x,则
Zn+2HCl=ZnCl2+H2↑
1 2 1
x 0.05mol
=
,解得x=0.1mol,剩余的盐酸物质的量是:0.1L×2mol?L-1-0.1mol=0.1mol,反应后溶液的体积仍为100mL,则反应后溶液中的H+物质的量浓度为
=1mol/L,
答:反应后溶液中的H+物质的量浓度为1mol/L.
| 1.12L |
| 22.4L/mol |
Zn+2HCl=ZnCl2+H2↑
1 2 1
x 0.05mol
| 2 |
| x |
| 1 |
| 0.05mol |
| 0.1mol |
| 0.1L |
答:反应后溶液中的H+物质的量浓度为1mol/L.
点评:本题考查学生根据化学方程式进行计算的知识,注意发生反应的物质的量的多少之间的关系是解题的关键,难度中等.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案
相关题目
在酸性无色溶液中,可以大量共存的离子组是( )
| A、K+、Na+、Cl-、CO32- |
| B、Cu2+、Cl-、Na+、SO42- |
| C、Ca2+、Na+、Cl-、NO3- |
| D、Fe3+、NH4+、SCN-、HCO3-、 |
化学与工农业生产、环境保护、日常生活等方面有广泛联系,下列叙述正确的是( )
| A、地沟油由于混有一些对人体有害的杂质而不能食用,可加工制成生物柴油,生物柴油的成分与从石油中提取的柴油成分相同 |
| B、大豆蛋白、鸡蛋白分别溶于水所形成的分散系为胶体,在加热、甲醛、饱和(NH4)2SO4、X射线作用下,蛋白质的性质都会改变并发生变性 |
| C、棉花和木材的主要成分都是纤维素,蚕丝和羊毛的主要成分都是蛋白质 |
| D、石油裂解和油脂皂化都是高分子生成小分子的过程 |
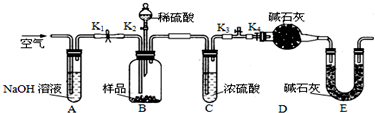
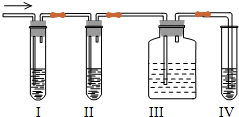
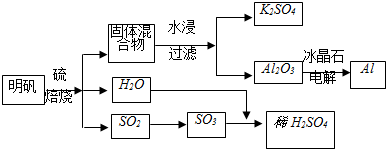
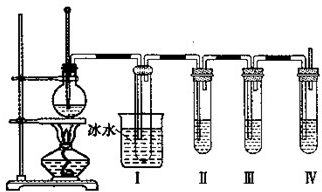 实验室制取乙烯并进行乙烯性质实验的装置如图所示,请回答:
实验室制取乙烯并进行乙烯性质实验的装置如图所示,请回答: