题目内容
氯气是一种重要的化工原料.大量用于制造盐酸、有机溶剂和杀菌消毒剂等.
(1)工业上通过氯碱工业制备氯气,其化学方程式为 .
(2)实验室常温下可用高锰酸钾和浓盐酸反应制取氯气,同时生成Mn2+等,反应的离子方程式为 .
(3)资料显示:Ca(ClO)2+CaCl2+2H2SO4
2CaSO4+2Cl2↑+2H2O,某学习小组利用此反应原理设计如图所示装置制取氯气并探究其性质.
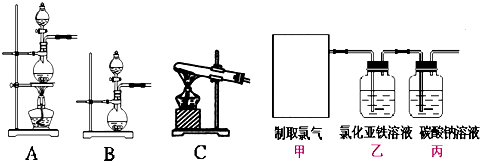
①该实验中,甲部分的装置是 (填字母);
②乙装置中发生反应的离子方程式是 ;选择合适的试剂证明该反应已发生的实验方法和现象是 .
③丙装置中通入少量氯气可制取日常生活中常用的漂白、消毒剂,则丙中发生反应的化学方程式是 .
④该实验存在明显缺陷,改进的方法是 .
(4)为测定漂白粉中Ca(ClO)2的质量分数,该小组将1.0g漂白粉配制成500mL溶液,取出50mL并向其中依次加入过量稀H2SO4、过量KI溶液,完全反应后,在滴入0.1mol/L Na2S2O3溶液(发生反应:2Na2S2O3+I2═Na2S4O6+2NaI),共消耗20mL Na2S2O3,则漂白粉中Ca(ClO)2的质量分数为 .
(1)工业上通过氯碱工业制备氯气,其化学方程式为
(2)实验室常温下可用高锰酸钾和浓盐酸反应制取氯气,同时生成Mn2+等,反应的离子方程式为
(3)资料显示:Ca(ClO)2+CaCl2+2H2SO4
| ||

①该实验中,甲部分的装置是
②乙装置中发生反应的离子方程式是
③丙装置中通入少量氯气可制取日常生活中常用的漂白、消毒剂,则丙中发生反应的化学方程式是
④该实验存在明显缺陷,改进的方法是
(4)为测定漂白粉中Ca(ClO)2的质量分数,该小组将1.0g漂白粉配制成500mL溶液,取出50mL并向其中依次加入过量稀H2SO4、过量KI溶液,完全反应后,在滴入0.1mol/L Na2S2O3溶液(发生反应:2Na2S2O3+I2═Na2S4O6+2NaI),共消耗20mL Na2S2O3,则漂白粉中Ca(ClO)2的质量分数为
考点:氯、溴、碘的性质实验
专题:实验题
分析:(1)电解饱和食盐水可以得到氢氧化钠、氯气和氢气;
(2)在酸性条件下,MnO4-被还原成Mn2+,用高锰酸钾跟浓盐酸反应在室温下制氯气,依据电荷守恒和原子守恒配平写出离子方程式;
(3)①根据反应物状态和反应条件选取反应装置;
②氯气能将亚铁离子氧化为铁离子,可用KSCN溶液检验铁离子的存在;
③氯气和水反应生成盐酸和次氯酸,盐酸和足量碳酸钠反应生成氯化钠和碳酸氢钠,次氯酸和碳酸钠反应生成次氯酸钠和碳酸氢钠;
④氯气有毒所以不能直接排空,所以缺少尾气处理装置.
(4)将方程式相加后使次氯酸钙和硫代硫酸钠在同一方程式中,根据次氯酸钙和硫代硫酸钠之间的关系式计算次氯酸钙的质量,然后根据质量分数公式计算即可.
(2)在酸性条件下,MnO4-被还原成Mn2+,用高锰酸钾跟浓盐酸反应在室温下制氯气,依据电荷守恒和原子守恒配平写出离子方程式;
(3)①根据反应物状态和反应条件选取反应装置;
②氯气能将亚铁离子氧化为铁离子,可用KSCN溶液检验铁离子的存在;
③氯气和水反应生成盐酸和次氯酸,盐酸和足量碳酸钠反应生成氯化钠和碳酸氢钠,次氯酸和碳酸钠反应生成次氯酸钠和碳酸氢钠;
④氯气有毒所以不能直接排空,所以缺少尾气处理装置.
(4)将方程式相加后使次氯酸钙和硫代硫酸钠在同一方程式中,根据次氯酸钙和硫代硫酸钠之间的关系式计算次氯酸钙的质量,然后根据质量分数公式计算即可.
解答:
解:(1)电解饱和食盐水可以得到氢氧化钠、氯气和氢气,反应为:2NaCl+2H2O
2NaOH+H2↑+Cl2↑,故答案为:2NaCl+2H2O
2NaOH+H2↑+Cl2↑;
(2)在酸性条件下,MnO4-被还原成Mn2+,用高锰酸钾跟浓盐酸反应在室温下制氯气,依据电荷守恒和原子守恒配平写出离子方程式为:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O,
故答案为:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;
(3)①根据该反应知,反应物是固液混合的,反应条件是加热,所以该反应需要的装置是固液混合加热型装置,故答案为:A;
②氯气能将亚铁离子氧化为铁离子,Cl2+2Fe2+=2Fe3++2Cl-,可用KSCN溶液检验是否生成铁离子,方法是取少量反应后的溶液置于洁净的试管中,向其中滴加KSCN溶液,若产生红色溶液,证明生成了Fe3+,则FeCl2与Cl2发生了氧化还原反应,
故答案为:Cl2+2Fe2+=2Fe3++2Cl-;取溶液少许于试管中滴加硫氰化钾溶液,溶液呈现血红色则证明该反应发生;
③氯气和水反应生成盐酸和次氯酸,盐酸和足量碳酸钠反应生成氯化钠和碳酸氢钠,次氯酸和碳酸钠反应生成次氯酸钠和碳酸氢钠,所以方程式为Cl2+2Na2CO3+H2O=NaCl+NaClO+2NaHCO3,
故答案为:Cl2+2Na2CO3+H2O═NaCl+NaClO+2NaHCO3;
④氯气是有毒气体所以不能直接排空,故应在丙装置后连接一个盛有NaOH溶液的洗气瓶防止氯气污染空气,故答案为:在丙装置后连接一个盛有氢氧化钠溶液的洗气瓶;
(4)将1.0g漂白粉配制成500mL溶液,取出50mL溶液,所以25mL溶液中漂白粉的质量为1.0g×
=0.1g.
Ca(ClO)2+4KI+2H2SO4=CaCl2+2K2SO4+2H2O+2I2 ①
2Na2S2O3+I2=Na2S4O6+2NaI②
设次氯酸钠的质量为x.
将方程式②×2+①相加得:
Ca(ClO)2+4KI+2H2SO4+4Na2S2O3=CaCl2+2K2SO4+2H2O+2Na2S4O6+4NaI
143g 4mol
x 0.1mol?L-1×0.02L
x=0.0715g
所以漂白粉中Ca(ClO)2的质量分数为
×100%=71.5%,故答案为:71.5%.
| ||
| ||
(2)在酸性条件下,MnO4-被还原成Mn2+,用高锰酸钾跟浓盐酸反应在室温下制氯气,依据电荷守恒和原子守恒配平写出离子方程式为:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O,
故答案为:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;
(3)①根据该反应知,反应物是固液混合的,反应条件是加热,所以该反应需要的装置是固液混合加热型装置,故答案为:A;
②氯气能将亚铁离子氧化为铁离子,Cl2+2Fe2+=2Fe3++2Cl-,可用KSCN溶液检验是否生成铁离子,方法是取少量反应后的溶液置于洁净的试管中,向其中滴加KSCN溶液,若产生红色溶液,证明生成了Fe3+,则FeCl2与Cl2发生了氧化还原反应,
故答案为:Cl2+2Fe2+=2Fe3++2Cl-;取溶液少许于试管中滴加硫氰化钾溶液,溶液呈现血红色则证明该反应发生;
③氯气和水反应生成盐酸和次氯酸,盐酸和足量碳酸钠反应生成氯化钠和碳酸氢钠,次氯酸和碳酸钠反应生成次氯酸钠和碳酸氢钠,所以方程式为Cl2+2Na2CO3+H2O=NaCl+NaClO+2NaHCO3,
故答案为:Cl2+2Na2CO3+H2O═NaCl+NaClO+2NaHCO3;
④氯气是有毒气体所以不能直接排空,故应在丙装置后连接一个盛有NaOH溶液的洗气瓶防止氯气污染空气,故答案为:在丙装置后连接一个盛有氢氧化钠溶液的洗气瓶;
(4)将1.0g漂白粉配制成500mL溶液,取出50mL溶液,所以25mL溶液中漂白粉的质量为1.0g×
| 1 |
| 10 |
Ca(ClO)2+4KI+2H2SO4=CaCl2+2K2SO4+2H2O+2I2 ①
2Na2S2O3+I2=Na2S4O6+2NaI②
设次氯酸钠的质量为x.
将方程式②×2+①相加得:
Ca(ClO)2+4KI+2H2SO4+4Na2S2O3=CaCl2+2K2SO4+2H2O+2Na2S4O6+4NaI
143g 4mol
x 0.1mol?L-1×0.02L
x=0.0715g
所以漂白粉中Ca(ClO)2的质量分数为
| 0.0715g |
| 0.1g |
点评:本题考查了氯气的性质,为高频考点,侧重于学生的分析、实验能力的考查,难度不大,注意把握实验的方法和操作注意事项,结合物质的性质解答该题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列各组离子中,能再溶液中大量共存的是( )
| A、Na+、H+、NO3-、Fe2+ |
| B、Ca2+、NO3-、HCO3-、OH- |
| C、K+、H+、Cl-、SO42- |
| D、Fe3+、Cl-、H+、CO32- |
NA为阿伏加德罗常数,下列叙述中正确的有( )
| A、1molFeCl3完全转化成氢氧化铁胶体后生成 NA个胶粒 |
| B、1molH2O2与MnO2充分作用后,转移2NA个电子 |
| C、标准状况下,22.4升H2与4克氦气均含NA个分子 |
| D、50℃,1×105Pa下46克NO2与0℃,2×105Pa下46克N2O4均含有3NA个原子 |
下列化合物中,不属于有机物的是( )
| A、甲烷 | B、淀粉 | C、碳酸镁 | D、蔗糖 |
在酸性无色溶液中,可以大量共存的离子组是( )
| A、K+、Na+、Cl-、CO32- |
| B、Cu2+、Cl-、Na+、SO42- |
| C、Ca2+、Na+、Cl-、NO3- |
| D、Fe3+、NH4+、SCN-、HCO3-、 |
 .如图所示是九种化合物的转变关系.
.如图所示是九种化合物的转变关系.