题目内容
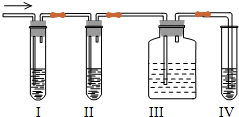
 某课外活动小组用题图探究铝镁合金的组成.
某课外活动小组用题图探究铝镁合金的组成.(1)A中试剂为1mol/L的NaOH溶液.该小组欲配制240mL1mol/L的NaOH溶液,下列叙述错误的是
A.取用240mL的容量瓶
B.应称量的NaOH固体质量为10.0g
C.定容摇匀后发现液面低于刻度线,再加蒸馏水与刻度线相切,所配溶液浓度偏小
D.称量NaOH固体时,需要在天平两端放上两张相同的称量纸
(2)实验前将铝镁合金在稀酸中浸泡目的(用离子方程式表示):
①
(3)检查装置气密性的方法
(4)B中发生反应的离子方程式为
(5)若实验用铝镁合金的质量为a g,与足量NaOH溶液反应后测得氢气体积为b L(已换算为标准状况),B中剩余固体的质量为
(6)另一活动小组称取a g合金,与足量HCl溶液反应得到标准状况时的氢气c L,铝镁合金中铝的质量分数为
考点:铝的化学性质,镁的化学性质,探究物质的组成或测量物质的含量
专题:几种重要的金属及其化合物
分析:(1)根据溶液配制分析;
(2)稀酸与合金反应;
(3)检查装置的气密性;
(4)铝与NaOH溶液反应;
(5)铝镁合金加入NaOH,Mg不反应,据此计算Mg的质量;
(6)铝镁合金加入HCl,反应生成氢气,列方程可计算铝的质量分数.
(2)稀酸与合金反应;
(3)检查装置的气密性;
(4)铝与NaOH溶液反应;
(5)铝镁合金加入NaOH,Mg不反应,据此计算Mg的质量;
(6)铝镁合金加入HCl,反应生成氢气,列方程可计算铝的质量分数.
解答:
解:(1)A.实验室没有240mL的容量瓶.故A错误;
B.应称量的NaOH固体质量为10.0g,故B正确
C.定容摇匀后发现液面低于刻度线,再加蒸馏水与刻度线相切,体积增大,所配溶液浓度偏小,故C正确;
D.称量NaOH固体时,应放在小烧杯中,故D错误;
故答案为:AD;
(2)铝镁合金溶于稀酸,离子方程式为:Al2O3+6H+=2Al3++3H2O、MgO+2H+=Mg2++H2O,
故答案为:Al2O3+6H+=2Al3++3H2O;MgO+2H+=Mg2++H2O;
(3)可以利用压强差检验装置的气密性,往D管中加入一定量的水,关闭分液漏斗活塞,上提D管,若C、D有稳定的液柱差,则装置气密性良好,
故答案为:往D管中加入一定量的水,关闭分液漏斗活塞,上提D管,若C、D有稳定的液柱差,则装置气密性良好;
(4)铝与NaOH溶液反应,方程式为2Al+2H2O+2OH-=2AlO2-+3H2↑;
故答案为:2Al+2H2O+2OH-=2AlO2-+3H2↑;
(5)根据关系式:2Al~3H2,Al的物质
,则剩余固体Mg的质量为ag-
g=
g;
故答案为:
;
(6)根据关系式:Mg~H2、2Al~3H2,设Mg的物质的量为x,Al的物质的量为y
,解之得y=(
-
)mol,铝镁合金中铝的质量分数为分数为为:
×100%;
故答案为:
×100%.
B.应称量的NaOH固体质量为10.0g,故B正确
C.定容摇匀后发现液面低于刻度线,再加蒸馏水与刻度线相切,体积增大,所配溶液浓度偏小,故C正确;
D.称量NaOH固体时,应放在小烧杯中,故D错误;
故答案为:AD;
(2)铝镁合金溶于稀酸,离子方程式为:Al2O3+6H+=2Al3++3H2O、MgO+2H+=Mg2++H2O,
故答案为:Al2O3+6H+=2Al3++3H2O;MgO+2H+=Mg2++H2O;
(3)可以利用压强差检验装置的气密性,往D管中加入一定量的水,关闭分液漏斗活塞,上提D管,若C、D有稳定的液柱差,则装置气密性良好,
故答案为:往D管中加入一定量的水,关闭分液漏斗活塞,上提D管,若C、D有稳定的液柱差,则装置气密性良好;
(4)铝与NaOH溶液反应,方程式为2Al+2H2O+2OH-=2AlO2-+3H2↑;
故答案为:2Al+2H2O+2OH-=2AlO2-+3H2↑;
(5)根据关系式:2Al~3H2,Al的物质
| 2b |
| 22.4×3 |
| 2b×27 |
| 22.4×3 |
| 22.4a-18b |
| 22.4 |
故答案为:
| 22.4a-18b |
| 22.4 |
(6)根据关系式:Mg~H2、2Al~3H2,设Mg的物质的量为x,Al的物质的量为y
|
| 4c |
| 33.6 |
| a |
| 9 |
| 72c-67.2a |
| 22.4a |
故答案为:
| 72c-67.2a |
| 22.4a |
点评:该题考查镁铝合金中镁质量分数测定探究实验的有关判断,是高考中的常见题型,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
下列说法正确的是( )
A、用惰性电极电解饱和氯化钠溶液的总反应为:2Cl-+2H+
| ||||
| B、锌铜原电池中盐桥中的阴离子移向ZnSO4溶液 | ||||
| C、镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀 | ||||
| D、电镀时,镀层金属作阳极;精炼铜时,用纯铜作阴极 |
下列化合物中,不属于有机物的是( )
| A、甲烷 | B、淀粉 | C、碳酸镁 | D、蔗糖 |
能说明醋酸是弱电解质的是( )
| A、用食醋可以除热水瓶内的水垢 |
| B、醋酸溶液用水稀释后氢离子浓度下降 |
| C、pH=2的醋酸溶液稀释1000倍后pH小于5 |
| D、用浓H2SO4和醋酸钠固体共热可制得醋酸 |