题目内容
3.完全燃烧18.6克某液态有机物(C、H、O),将生成的气体通过浓硫酸,浓硫酸增重16.2克,剩余的气体通过碱石灰,气体的质量减少26.4克.若取上述等量的有机物完全溶于水,可以得到2摩尔/升的溶液150毫升,求此有机物的分子式.分析 根据所得溶液浓度及体积可计算出18.6g该有机物的物质的量,然后根据M=$\frac{m}{n}$可计算出该有机物的摩尔质量、相对分子质量;浓硫酸增重为水的质量,碱石灰增重的质量为二氧化碳的质量,分别根据n=$\frac{m}{M}$计算出生成水和二氧化碳的物质的量,然后利用质量守恒定律计算出该有机物分子中含有C、H原子数,最后根据其相对分子质量计算出含有氧原子数目,从而得出其分子式.
解答 解:150mL 2mol/L的溶液中含有溶质的物质的量为:2mol/L×0.15L=0.3mol,说明18.6g该有机物的物质的量为0.3mol,则该有机物的摩尔质量为:$\frac{18.6g}{0.3mol}$=62g/mol,其相对分子质量为62;
浓硫酸增重的为水的质量,则水的物质的量为:n(H2O)=$\frac{16.2g}{18g/mol}$=0.9mol,则该有机物分子中含有H原子数为:$\frac{0.9mol×2}{0.3mol}$=6,
碱石灰增重的质量为二氧化碳,生成二氧化碳的物质的量为:n(CO2)=$\frac{26.4g}{44g/mol}$=0.6mol,该有机物分子中含有C原子的数目为:$\frac{0.6mol}{0.3mol}$=2,
则该有机物分子中含有氧原子的数目为:$\frac{62-12×2-1×6}{16}$=2,
所以该有机物的分子式为:C2H6O2,
答:该有机物的分子式为C2H6O2.
点评 本题考查了有机物分子式确定的计算,题目难度中等,明确相对分子质量与摩尔质量的关系为解答关键,注意掌握质量守恒定律在确定有机物分子式中的应用,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
14.在溶液导电性实验中,往氢氧化钡溶液中滴加硫酸至过量,灯泡的明亮度变化是:明→暗→明,下列说法正确的是( )
| A. | 溶液的导电性与溶液中离子的浓度有关 | |
| B. | 溶液的导电性与溶液中离子数目的多少有关 | |
| C. | 灯泡最暗时溶液中无自由移动的离子 | |
| D. | 往氢氧化钡溶液中滴加盐酸与滴加硫酸时现象相同 |
11.下列化学用语中错误的是( )
| A. | CH4分子的比例模型: | B. | 异丁烷的结构简式: | ||
| C. | 乙烷的最简式:CH3 | D. | 乙烯的结构式: |
8.下列各组物质中,既能用酸性KMnO4 溶液,又能用溴水鉴别的是( )
| A. | 苯和甲苯 | B. | 苯乙烯与苯 | ||
| C. | 1-戊烯和邻-二甲苯 | D. | 苯和NaI溶液 |
2.某化学兴趣小组欲对含少量硫酸亚铁和硫酸铁的硫酸铜溶液进行综合实验:
(1)除去Fe2+和Fe3+并制备CuSO4•5H2O,请根据以下流程回答问题:
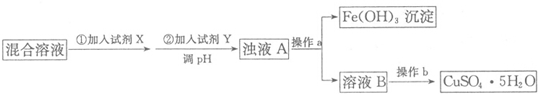
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
①试剂X的化学式为H2O2,加入试剂Y调节溶液pH的范围是3.7-4.7;
②操作a用到的玻璃仪器为烧杯,玻璃棒和漏斗;操作b的名称为蒸发浓缩、冷却结晶;
(2)已知:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,欲测定混合溶液中的Fe2+的浓度,取待测液20.00mL,用浓度为0.01mol•L-1的酸性KMnO4溶液滴定,下列滴定方式中,最合理的是b(填字母序号,夹持部分已略去)
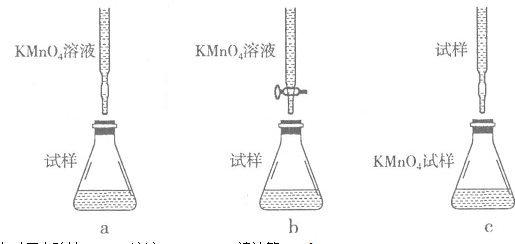
达到终点时用去酸性KMnO4溶液12.00mL,请计算c(Fe2+)=0.03mol/L.
(1)除去Fe2+和Fe3+并制备CuSO4•5H2O,请根据以下流程回答问题:

有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 1.9 | 6.5 | 4.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 6.7 |
②操作a用到的玻璃仪器为烧杯,玻璃棒和漏斗;操作b的名称为蒸发浓缩、冷却结晶;
(2)已知:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,欲测定混合溶液中的Fe2+的浓度,取待测液20.00mL,用浓度为0.01mol•L-1的酸性KMnO4溶液滴定,下列滴定方式中,最合理的是b(填字母序号,夹持部分已略去)

达到终点时用去酸性KMnO4溶液12.00mL,请计算c(Fe2+)=0.03mol/L.
3.“类推”是一种重要的学习方法,但有时会产生错误结论,下列类推结论中正确的是( )
| A. | 碱金属氟化物的晶格能顺序是LiF>NaF>KF>RbF>CsF;则钠的卤化物的晶格能顺序是NaF>NaCl>NaBr>NaI | |
| B. | ⅣA族元素氢化物沸点顺序是GeH4>SiH4>CH4;则ⅤA族元素氢化物沸点顺序是AsH3>PH3>NH3 | |
| C. | 晶体中有阴离子,必有阳离子;则晶体中有阳离子,必有阴离子 | |
| D. | 若盐酸的浓度是醋酸浓度的2倍;则盐酸中H+浓度也是醋酸中H+浓度的2倍 |
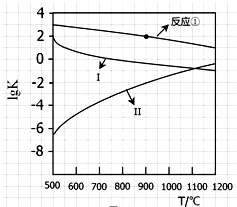 用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应.
用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应. .
.