题目内容
18.将22克CH4和C2H4的混合气体通入盛有足量溴水的容器中,气体的质量减少了14克,则混合气体中CH4和C2H4的物质的量之比为( )| A. | 1:1 | B. | 1:2 | C. | 2:1 | D. | 2:3 |
分析 甲烷不与溴水反应,则气体减少的质量为乙烯的质量,混合气体中甲烷的质量为22g-14g=8g,然后根据n=$\frac{m}{M}$计算出甲烷、乙烯的物质的量,然后计算出混合气体中CH4和C2H4的物质的量之比.
解答 解:将22克CH4和C2H4的混合气体通入盛有足量溴水的容器中,气体的质量减少了14克,由于甲烷不参与反应,则溴水增重的质量为C2H4的质量,故混合气体中CH4的质量为:22g-14g=8g,
所以混合气体中CH4和C2H4的物质的量分别为:n(CH4)=$\frac{8g}{16g/mol}$=0.5mol、n(C2H4)=$\frac{14g}{28g/mol}$=0.5mol,CH4和C2H4的物质的量之比=0.5mol:0.5mol=1:1,
故选A.
点评 本题考查了物质的量的计算、混合物的计算,题目难度不大,明确常见有机物性质为解答关键,注意掌握物质的量与摩尔质量之间的关系,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
8.一定条件下,体积为10L的密闭容器中,1mol X和1mol Y进行反应:2X(g)+Y(g)?Z(g),经60s达到平衡,生成0.3mol Z.下列说法正确的是( )
| A. | 将容器体积变为20 L,Z的平衡浓度变为原来的1/2 | |
| B. | 以X的反应速率为0.001 mol•L-1•s-1 | |
| C. | 若增大压强,则物质Y的转化率减小 | |
| D. | 若升高温度,X的体积分数增大,则该反应的△H>0 |
9.为测定某有机化合物A的结构,通过实验得出以下数据:
①将有机化合物A置于氧气流中充分燃烧,实验测得生成5.4g H2O和8.8g CO2.
②利用质谱仪测定出有机化合物A的相对分子质量为46.
③将9.2g该有机物与足量的金属钠反应,测得在标准状态下产生的氢气为2.24L.
下列有关A说法正确的是( )
①将有机化合物A置于氧气流中充分燃烧,实验测得生成5.4g H2O和8.8g CO2.
②利用质谱仪测定出有机化合物A的相对分子质量为46.
③将9.2g该有机物与足量的金属钠反应,测得在标准状态下产生的氢气为2.24L.
下列有关A说法正确的是( )
| A. | A中碳原子与氢原子的个数比是1:3,无法确定A中是否含有氧原子 | |
| B. | A的一种同分异构体的结构简式:CH3OCH3 | |
| C. | A物质可以发生消去、取代、加成反应 | |
| D. | A与乙二酸可以通过缩聚反应生成高分子化合物 |
13.下列电子式书写错误的是( )
| A. | 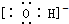 | B. | 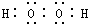 | C. | 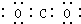 | D. | 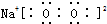 |
3.下列物质中俗称为纯碱的是( )
| A. | NaHCO3 | B. | NaOH | C. | Na2CO3 |
7.下列图象分别表示有关反应的反应过程与能量变化的关系,据此判断下列说法中正确的是( )
| A. | 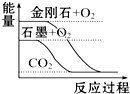 石墨转变为金刚石是吸热反应 | |
| B. | 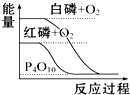 白磷比红磷稳定 | |
| C. | 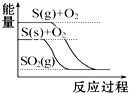 S(g)+O2(g)═SO2(g)△H1 S(s)+O2(g)═SO2(g)△H2 则△H1>△H2 | |
| D. | 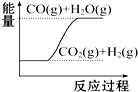 CO(g)+H2O(g)═CO2(g)+H2(g)△H1>0 |
8.假设某化学反应的反应过程如下图所示观察分析,符合图中变化的化学反应为( )


| A. | A2+3B2?2AB3 | B. | 2AB2+B2?2AB3 | C. | 2A2 B+5B2═4AB3 | D. | 2AB2+B2═2AB |