题目内容
16.设NA为阿伏加德罗常数的数值,下列说法中正确的是( )| A. | 在密闭容器中加入l.5mol H2和0.5molN2,充分反应后可得到NH3分子数为NA | |
| B. | 8.8g乙酸乙酯中含共用电子对数为1.4 NA | |
| C. | 1 L 0.1 mol•L-1氯化铜溶液中铜离子数为0.1 NA | |
| D. | 标准状况下,22.4L的CCl4中含有的CCl4分子数为NA |
分析 A、合成氨的反应为可逆反应;
B、求出乙酸乙酯的物质的量,然后根据1mol乙酸乙酯中含14mol共用电子对来分析;
C、铜离子为弱碱阳离子,在溶液中会水解;
D、标况下四氯化碳为液态.
解答 解:A、合成氨的反应为可逆反应,不能进行彻底,故生成的氨气分子个数小于NA个,故A错误;
B、8.8g乙酸乙酯的物质的量为0.1mol,而1mol乙酸乙酯中含14mol共用电子对,故0.1mol乙酸乙酯中含1.4NA对共用电子对,故B正确;
C、铜离子为弱碱阳离子,在溶液中会水解,故溶液中铜离子的个数小于0.1NA个,故C错误;
D、标况下四氯化碳为液态,故不能根据气体摩尔体积来计算其物质的量和含有的分子个数,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.下列图象分别表示有关反应的反应过程与能量变化的关系,据此判断下列说法中正确的是( )
| A. | 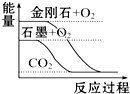 石墨转变为金刚石是吸热反应 | |
| B. | 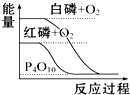 白磷比红磷稳定 | |
| C. | 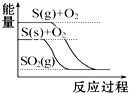 S(g)+O2(g)═SO2(g)△H1 S(s)+O2(g)═SO2(g)△H2 则△H1>△H2 | |
| D. | 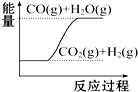 CO(g)+H2O(g)═CO2(g)+H2(g)△H1>0 |
4.你认为下列数据可信的是( )
| A. | 用广泛pH试纸测得某盐酸溶液的pH是3.2 | |
| B. | 某常见气体的密度为1.8g/cm3 | |
| C. | 某澄清石灰水的浓度为2mol/L | |
| D. | 某元素的原子半径是0.160nm |
11.实验室用浓盐酸与二氧化锰制取氯气,收集到氯气0.112L(折合成标准状况),则被氧化的HCl的物质的量是( )
| A. | 0.02 mol | B. | 0.01 mol | C. | 0.04 mol | D. | 无法计算 |
1.下列说法不正确的是( )
| A. | 第二周期元素从C到F,非金属性逐渐减弱 | |
| B. | 第三周期元素从Na到Cl,原子半径逐渐增大 | |
| C. | HF、HCl、HBr、HI的热稳定性依次减弱 | |
| D. | LiOH、NaOH、KOH的碱性依次增强 |
8.假设某化学反应的反应过程如下图所示观察分析,符合图中变化的化学反应为( )


| A. | A2+3B2?2AB3 | B. | 2AB2+B2?2AB3 | C. | 2A2 B+5B2═4AB3 | D. | 2AB2+B2═2AB |
5.下列化合物的核磁共振氢谱中出现两组峰且峰面积之比是2:1的是( )
| A. | 乙酸甲酯 | B. | 对苯二酚 | C. | 2--甲基丙烷 | D. | 对二甲苯 |
6.一定条件下,某容器中各微粒在反应前后变化的示意图如图所示,其中●和○代表不同元素的原子.关于此反应判断错误的是( )


| A. | 可能是双氧水分解反应 | |
| B. | 充分反应后,还有 物质,则属于可逆反应 物质,则属于可逆反应 | |
| C. | 反应前后,一定是共价键的断裂与生成 | |
| D. | 反应方程式可表示为2 =2 =2 + + |