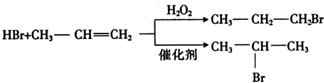
题目内容
有六瓶白色固体,它们是Al2O3、NaNO3、Ba(OH)2、MgCl2、(NH4)2SO4、无水CuSO4.现仅用蒸馏水及已被检出的物质对它们作出鉴别,根据以下步骤在空格内填入须加入的试剂,填写检出物质时须与实验现象上下对应.


考点:几组未知物的检验
专题:
分析:分析六种物质,首先可以知道硫酸铜溶于水呈蓝色,氧化铝为氧化物,不溶于水,故最先检出此两种物质;
解答:
解:(1)由于Al2O3难溶于水,故待检物加入水可以检出难溶于水的物质为Al2O3,由于无水CuSO4.溶于水后溶液呈蓝色,故此时可以检验得出有蓝色生成的是无水CuSO4,故答案为:Al2O3、CuSO4,有不溶于水的沉淀,生成蓝色溶液;
(2)利用检验得出的CuSO4逐滴加入剩余固体,有蓝色沉淀生成的是Ba(OH)2,故答案为:Ba(OH)2;蓝色沉淀;
(3)利用检验得出的Ba(OH)2逐滴加入剩余固体,有白色沉淀生成且有刺激性气体放出的是(NH4)2SO4,只生成白色沉淀的是MgCl2,剩余无现象的是NaNO3,故答案为:MgCl2、(NH4)2SO4、NaNO3; 白色沉淀、白色沉淀和刺激性气味气体、无现象.
(2)利用检验得出的CuSO4逐滴加入剩余固体,有蓝色沉淀生成的是Ba(OH)2,故答案为:Ba(OH)2;蓝色沉淀;
(3)利用检验得出的Ba(OH)2逐滴加入剩余固体,有白色沉淀生成且有刺激性气体放出的是(NH4)2SO4,只生成白色沉淀的是MgCl2,剩余无现象的是NaNO3,故答案为:MgCl2、(NH4)2SO4、NaNO3; 白色沉淀、白色沉淀和刺激性气味气体、无现象.
点评:本题主要考查的是常见物质的检验,熟记常见物质的溶解度表以及各种溶液或沉淀的颜色是解决本题的关键,有一定难度.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
将3.84克铜粉与一定质量浓硝酸反应,当铜完全作用时,收集到气体4.48L(标况下),则所消耗硝酸的物质的量是( )
| A、0.26mol |
| B、0.32mol |
| C、0.16mol |
| D、0.2mol |
已知:25℃时,有关弱酸的电离平衡常数:下列选项中正确的是( )
| 弱酸 | H2C2O4 | CH3COOH | HCN | H2CO3 |
| 电离常数Ki | Ki1=5.9×l0-2 Ki2=6.4×l0-5 | 1.8×l0-5 | 4.9×l0-10 | Ki1=4.3×l0-7 Ki2=5.6×l0-11 |
| A、等物质的量浓度的溶液pH关系:NaHCO3>NaCN>CH3COONa>NaHC2O4 |
| B、反应NaHC2O4+NaHCO3→Na2C2O4+H2O+CO2↑能发生 |
| C、等体积等物质的量浓度的溶液中离子总数:NaCN>CH3COONa |
| D、Na2CO3溶液中2c(Na+)=c(CO32-)+c(HCO3-)+c( H2CO3) |
下列关于甲烷的叙述正确的是( )
| A、甲烷不能使酸性高锰酸钾溶液退色,所以,甲烷不能被氧化 |
| B、甲烷可以与氯气发生取代反应,因此,可以使氯水褪色 |
| C、甲烷能够燃烧,在一定条件下会发生爆炸,因此,是矿井安全的重要威胁之一 |
| D、将甲烷与氯气以体积比为1:1的比例混合,光照条件下就可得到比较纯净的CH3Cl |

 (图中球与球之间的连线代表化学键,如单键、双键).则A的结构简式为
(图中球与球之间的连线代表化学键,如单键、双键).则A的结构简式为 在一体积为10L的容器中,通入一定量的CO和H2O在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2 (g),△H<0.CO和H2O浓度的变化如图.
在一体积为10L的容器中,通入一定量的CO和H2O在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2 (g),△H<0.CO和H2O浓度的变化如图. 咖啡酸(如图),存在于许多中药中,如野胡萝卜、光叶水苏、荞麦、木半夏等.咖啡酸有止血作用,特别对内脏的止血效果较好.
咖啡酸(如图),存在于许多中药中,如野胡萝卜、光叶水苏、荞麦、木半夏等.咖啡酸有止血作用,特别对内脏的止血效果较好. )是一种重要的化工原料,其合成路线如下:
)是一种重要的化工原料,其合成路线如下: