题目内容
12.某校化学兴趣小组为了探究粗铁粒与某浓度硝酸反应,设计了如下探究活动:探究一:称取粗铁粒10 g放入某浓度硝酸中,充分反应后得到溶液X并收集到气体Y.为了探究溶液X中铁的价态,同学甲设计如下实验:
现有药品和仪器:药品有:0.1 mol/L KSCN溶液,0.1 mol/L KI溶液,0.2 mol/L酸性高锰酸钾溶液,氯水等;器材有:试管和滴管.
(1)请你设计简单实验,探究上述猜想是否正确,填写下列实验报告.
| 实验步骤 | 操作 | 现象与结论 | 离子方程式 |
| 第一步 | 取少量溶液装于试管,向试管中加入几滴KSCN溶液 | ||
| 第二步 | 若溶液紫色褪去,则溶液含有Fe2+;若无明显变化,则不含Fe2+ |
(3)装置丙收集满气体后,通过气泡鼓入空气后,有红棕色气体生成,能否确定气体Y中含NO?说明理由不能确定,由于NO2与水反应也能生成NO,故不能确定气体Y中含NO.
(4)同学丙对同学乙的实验设计提出了质疑,他认为丙中的现象不足以证明NO存在,稍作改进即可.试回答改进措施:
(5)同学丁为了探究气体Y的组成,将224mL气体Y通入足量的NaOH溶液中,气体被完全吸收,所得溶液再用0.15mol/L 酸性KMnO4溶液滴定,消耗20mL KMnO4溶液.则气体Y中NO、NO2的体积比为:1:3.
(已知2NO2+2NaOH═NaNO3+NaNO2+H2O和NO2+NO+2NaOH═2NaNO2+H2O)
分析 (1)可以选择硫氰酸钾来检验三价铁离子,高锰酸根离子具有氧化性,可以将还原性的离子亚铁离子氧化;
(2)根据NO2与Na2S溶液反应的现象知识来回答;
(3)NO2与水反应也能生成NO和硝酸;
(4)丙中的现象不足以证明NO存在,NO2会存在干扰;
(5)可以根据化学方程式5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O进行相应的计算.
解答 解:(1)可以选择硫氰酸钾来检验三价铁离子,存在三价铁离子时,溶液变红色,亚铁离子具有还原性,可以被高锰酸钾氧化为三价铁离子,导致高锰酸钾褪色,故答案为:
| 步骤 | 操作 | 现象与结论 | 可能的离子方程式 |
| 第1步 | 若溶液变红色,则溶液含有Fe3+; 若无现象,则不含Fe3+ | Fe3++3SCN-=Fe(SCN)3 | |
| 第2步 | 另取少量溶液装于试管,向试管里滴加几滴酸性高锰酸钾溶液 | 5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O |
(3)由于NO2与水反应也能生成NO,故不能确定气体Y中含NO,可以在乙和丙装置间加一个检验NO2是否除尽装置,故答案为:不能确定,由于NO2与水反应也能生成NO,故不能确定气体Y中含NO;
(4)丙中的现象不足以证明NO存在,NO2会存在干扰,所以在乙和丙装置间加一个检验NO2是否除尽的装置,可以排除此方面的干扰,故答案为:在乙和丙装置间加一个检验NO2是否除尽装置;
(5)由5NO2-~2 MnO4-,故2n(NO2-)=7.5×10-3 mol,设NO、NO2的物质的量分别为x、y mol,则有:x+y=10×10-3 mol,2x+0.5(y-x)=7.5×10-3,
解得:x=2.5×10-3 mol,y=7.5×10-3 mol,气体Y中NO、NO2的体积比为1:3,
故答案为:1:3.
点评 本题是一道实验探究题目,考查学生分析和解决问题的能力,考查角度广,难度大.

练习册系列答案
相关题目
3.常温下,下列叙述错误的是( )
| A. | 向0.1mol•L-1的醋酸溶液中加水或通入HCl气体都能使$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$的值增大 | |
| B. | 0.1mol•L-1的醋酸钠溶液20mL与0.1mol•L-1盐酸10mL混合后溶液显酸性,则有c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH) | |
| C. | pH=4的醋酸与pH=10的氢氧化钠溶液等体积混合,所得溶液pH<7 | |
| D. | 0.1mol•L-1某一元酸HA溶液中$\frac{c(O{H}^{-})}{c({H}^{+})}$=1×10-6,则该溶液中由水电离出的c(H+)=1×10-11mol•L-1 |
7. 原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子的s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.
原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子的s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.
(1)Y原子核外共有7种不同运动状态的电子,基态T原子有7种不同能级的电子.
(2)X、Y、Z的第一电离能由小到大的顺序为C<O<N(用元素符号表示).
(3)由X、Y、Z形成的离子ZXY-与XZ2互为等电子体,则ZXY-中X原子的杂化轨道类型为sp杂化.
(4)Z与R能形成化合物甲,1mol甲中含4 mol化学键,甲与氢氟酸反应,生成物的分子空间构型分别为SiF4的正四面体形、H2O为V形.
(5)G、Q、R氟化物的熔点如表,造成熔点差异的原因为NaF与MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低,Mg2+的半径比Na+的半径小,且Mg2+电荷数高,晶格能MgF2>NaF,故MgF2的熔点比NaF高.
(6)向T的硫酸盐溶液中逐滴加入Y的氢化物的水溶液至过量,反应的离子方程式为Cu2++4NH3.H2O=[Cu(NH3)4]2++4H2O
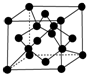
(7)X单质的晶胞如图所示,一个X晶胞中有8个X原子;若X晶体的密度为ρ g•cm-3,阿伏加德罗常数的值为NA,则晶体中最近的两个X原子之间的距离为$\frac{3}{4}$$\root{3}{\frac{12}{P{N}_{A}}}$ cm(用代数式表示).
 原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子的s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.
原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子的s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.(1)Y原子核外共有7种不同运动状态的电子,基态T原子有7种不同能级的电子.
(2)X、Y、Z的第一电离能由小到大的顺序为C<O<N(用元素符号表示).
(3)由X、Y、Z形成的离子ZXY-与XZ2互为等电子体,则ZXY-中X原子的杂化轨道类型为sp杂化.
(4)Z与R能形成化合物甲,1mol甲中含4 mol化学键,甲与氢氟酸反应,生成物的分子空间构型分别为SiF4的正四面体形、H2O为V形.
(5)G、Q、R氟化物的熔点如表,造成熔点差异的原因为NaF与MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低,Mg2+的半径比Na+的半径小,且Mg2+电荷数高,晶格能MgF2>NaF,故MgF2的熔点比NaF高.
| 氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 |
| 熔点/K | 993 | 1 539 | 183 |
(7)X单质的晶胞如图所示,一个X晶胞中有8个X原子;若X晶体的密度为ρ g•cm-3,阿伏加德罗常数的值为NA,则晶体中最近的两个X原子之间的距离为$\frac{3}{4}$$\root{3}{\frac{12}{P{N}_{A}}}$ cm(用代数式表示).
17.下列关于有机物的说法正确的是( )
| A. | 乙烯和苯分子中均含有碳碳双键,二者都能发生加成反应 | |
| B. | 汽油、煤油、植物油均为含碳、氢、氧三种元素的化合物 | |
| C. | 苯、乙醇和乙酸都能发生取代反应 | |
| D. | 羊毛、蚕丝和棉花等天然高分子材料的主要成分都是蛋白质 |
4.向容积相同的五个密闭容器中,分别充入等物质的量NH3和HCl,在不同温度下,任其发生反应NH3(g)+HCl(g)?NH3Cl(s),并在相同时间测定NH4Cl的质量,如图.下列说法正确的是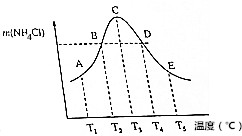 ( )
( )
 ( )
( )| A. | 不同温度下的平衡常数K3<K4<K5 | |
| B. | 正反应速率:vB=vD | |
| C. | 当体系气体的平均相对分子质量不再改变时,不能说明反应达到平衡状态 | |
| D. | A、B、D、E点均未达到平衡状态,C点达到平衡状态 |
2.主族元素在周期表中的位置取决于该主族元素原子的( )
| A. | 相对原子质量和电子数 | B. | 电子层数和最外层电子数 | ||
| C. | 电子层数和次外层电子数 | D. | 相对原子质量和最外层电子数 |
 硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾.
硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾. (2)乙炔的结构式H-C≡C-H
(2)乙炔的结构式H-C≡C-H