题目内容
20.请根据氧化还原反应Cu+2Fe3+═2Fe2++Cu2+设计成原电池:(1)负极发生的电极反应方程式为:Fe-2e-=Fe2+,电流流入(填“流出”或“流入”),该反应为氧化反应(填“氧化反应”或“还原反应”).
(2)若电路中转移6.02×1022个e-,则负极减轻2.8克.
分析 根据反应“Cu+2Fe3+═2Fe2++Cu2+”分析,在反应中,Fe被氧化,失电子,应为原电池的负极,正极为活泼性较Fe弱的Cu,Cu2+在正极上得电子被还原,电解质溶液为CuSO4溶液,原电池中,电流从正极经外电路流向负极,由此分析解答.
解答 解:(1)在反应中,Fe被氧化,失电子,应为原电池的负极,负极反应式为 Fe-2e-=Fe2+,电流从正极流向负极,负极发生氧化反应;
故答案为:Fe-2e-=Fe2+;流入;氧化反应;
(2)若电路中转移6.02×1022个e-,即转移0.1mol电子,由负极反应式为 Fe-2e-=Fe2+可知,反应的Fe为0.05mol,其质量为0.05mol×56g/mol=2.8g;
故答案为:2.8.
点评 本题考查了原电池原理,明确原电池中元素化合价升降与正负极的关系是解本题关键,再结合电子移动方向分析解答,题目难度不大.

练习册系列答案
相关题目
10.250℃时,向一2L的恒容密闭容器内充入1molCO和2molH2,发生反应:CO(g)+2H2(g)?CH3OH(g)△H<0,测得容器内压强的变化如表:
下列说法错误的是( )
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
| 压强/MPa | 12.6 | 10.8 | 9.5 | 8.7 | 8.4 | 8.4 |
| A. | 当容器中气体的压强保持不变时,说明该反应已达平衡 | |
| B. | 0~20min内,以CO表示的平均反应速率为0.0125mol•L-1•min-1 | |
| C. | 该温度下平衡常数K的数值为16 | |
| D. | 升高温度,K值减小 |
8.在1L的密闭容器中通入2molNH3,在一定温度下发生如下反应:2NH3(g)?N2(g)+3H2(g),达列平衡时,容器内N2的百分含量为a%,若维持容器的体积和温度都不变,分别通入下列初始物质,达到平衡时,容器内N2的百分含量也为a%的是( )
| A. | 3molH2+1molN2 | B. | 2molNH3+1molN2 | ||
| C. | 2molN2+3molH2 | D. | 0.1molNH3+0.95molN2+2.85molH2 |
15.设NA为阿伏伽德罗常数的数值,下对说法正确的是( )
| A. | 标准状况下22.4 L甲苯含有8NA个C-H键 | |
| B. | 1L1 mol•L-1的Na2S溶液中含有NA个S2- | |
| C. | 46gNa与足量H2O反应完全后可生成NA个H2分子 | |
| D. | 1molCu和少量浓硝酸反应完全后可生成2NA个NO2分子 |
3.取n g某物质在氧气中完全燃烧,将其产物跟足量的过氧化钠固体完全反应,反应后固体的质量恰好也增加了n g.下列物质中不能满足上述结果的是( )
| A. | H2和CO的混合气 | B. | C2H2O2 | C. | C3H6O3 | D. | C6H12O5 |
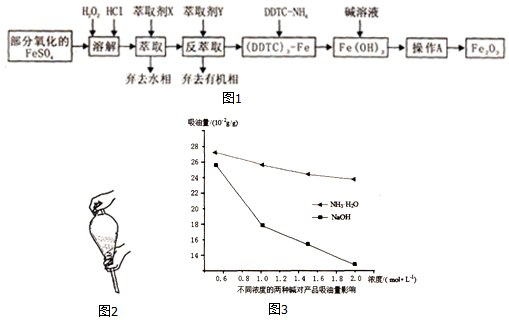
 .
. ,R→S的化学方程式为
,R→S的化学方程式为 .
.
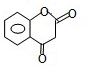 .
.
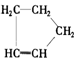 是环戊烯的结构简式,可进一步简写为
是环戊烯的结构简式,可进一步简写为 .环戊烯的化学性质跟烯烃相似.
.环戊烯的化学性质跟烯烃相似.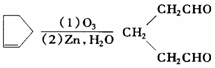
 )臭氧分解各种产物的结构简式及物质的量之比:HCHO、
)臭氧分解各种产物的结构简式及物质的量之比:HCHO、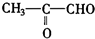 ;2:1.
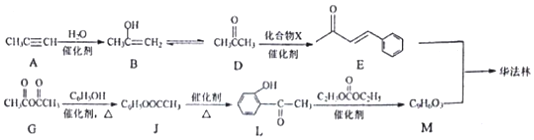
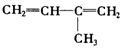
;2:1.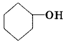 )合成乙二醛(
)合成乙二醛( 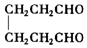 )的各步合成路线流程.
)的各步合成路线流程.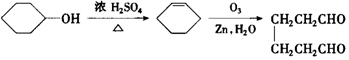 .
.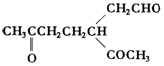 .A经催化加氢得产物B,B的分子式是C10H20.分析数据表明,分子B内含有六元碳环.请写出A和B的结构简式(不必注明名称).
.A经催化加氢得产物B,B的分子式是C10H20.分析数据表明,分子B内含有六元碳环.请写出A和B的结构简式(不必注明名称).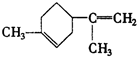 ,B是
,B是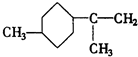 .
.