题目内容
10.250℃时,向一2L的恒容密闭容器内充入1molCO和2molH2,发生反应:CO(g)+2H2(g)?CH3OH(g)△H<0,测得容器内压强的变化如表:| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
| 压强/MPa | 12.6 | 10.8 | 9.5 | 8.7 | 8.4 | 8.4 |
| A. | 当容器中气体的压强保持不变时,说明该反应已达平衡 | |
| B. | 0~20min内,以CO表示的平均反应速率为0.0125mol•L-1•min-1 | |
| C. | 该温度下平衡常数K的数值为16 | |
| D. | 升高温度,K值减小 |
分析 A.反应中气体的物质的量逐渐减小,压强逐渐减小;
B.根据压强之比等于物质的量之比,结合利用三段式计算平衡时各物质的浓度以及转化的浓度,再根据v=$\frac{△c}{t}$计算;
C.根据K=$\frac{c(C{H}_{3}OH)}{c(CO)•{c}^{2}({H}_{2})}$计算;
D.该反应为放热反应,升高温度平衡逆向移动.
解答 解:A.反应中气体的物质的量逐渐减小,压强逐渐减小,所以当容器中气体的压强保持不变时,各物质的物质的量不变,说明该反应已达平衡,故A正确;
B. CO(g)+2H2(g)?CH3OH(g)
开始(mol):1 2 0
转化(mol):x 2x x
平衡(mol):1-x 2-2x x
根据压强之比等于物质的量之比可知,$\frac{1-x+2-2x+x}{3}$=$\frac{8.4}{12.6}$,解得x=0.5,则v=$\frac{△c}{t}$=$\frac{\frac{0.5mol}{2L}}{20min}$=0.0125mol•L-1•min-1,故B正确;
C.由B可知,K=$\frac{c(C{H}_{3}OH)}{c(CO)•{c}^{2}({H}_{2})}$=$\frac{\frac{0.5mol}{2L}}{(\frac{0.5mol}{2L})•(\frac{1mol}{2L})^{2}}$=4,故C错误;
D.该反应为放热反应,升高温度平衡逆向移动,所以K值减小,故D正确.
故选C.
点评 本题考查了化学平衡的有关计算,题目难度中等,注意把握三段式在化学平衡计算中的应用以及恒容条件下压强与物质的量的关系,侧重于考考查学生的分析能力和计算能力.

| A. | 1.96% | B. | 5.66% | C. | 75% | D. | 12.5% |
| A. | 用水无法鉴别乙醇、甲苯和溴苯 | |
| B. | 可用酸性高锰酸钾溶液除去甲烷中的乙烯 | |
| C. | C2H5OOCCOOC2H5的名称:二乙酸乙二酯 | |
| D. | 除去苯中的苯酚可加入氢氧化钠溶液后分液 |
| A. |  | B. |  | C. |  | D. |  |
| A. | 探究SO2和Na2O2可能化合生成Na2SO4 | |
| B. | 探究NO和N2O可能化合生成NO2 | |
| C. | 探究铜在灼烧时出现的黑色物质可能是炭黑 | |
| D. | 探究红色酚酞试液通入Cl2褪色,原因是溶液酸碱性改变或被漂白 |
| 1.0 MPa | 2.0 MPa | 3.0 MPa | |
| 810℃ | 54.0% | a | b |
| 915℃ | c | 75.0% | d |
| 1000℃ | e | f | 83.0% |
上述①~④中正确的有( )
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
C(石墨,s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
C(金刚石,s)+O2(g)═CO2(g)△H=-395.4kJ•mol-1
据此推理所得到的下列结论中,正确的是( )
| A. | 金刚石燃烧比石墨燃烧放出的热量少 | |
| B. | 等质量是石墨燃烧放热多 | |
| C. | 石墨的能量比金刚石的能量高 | |
| D. | 由石墨制备金刚石一定是吸热反应 |
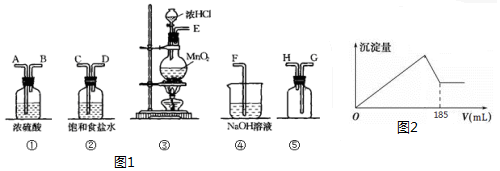
 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O