题目内容
6.手机中使用的锂(Li)电池电板是新型的高能电池,以质量轻、电容量大而受到普遍重视,目前已制成多种功能的锂电池,某种锂电池的总反应可表示为Li+MnO2=LiMnO2,在此反应中锂元素的化合价变化0→+1,下列对锰元素的化合价变化判断正确的是( )| A. | +4→+3 | B. | +2→+3 | C. | 0→+2 | D. | -4→-2 |
分析 根据单质中元素的化合价为0、化合物中正负化合价代数和为零,结合各化学式进行解答本题.
解答 解:某种锂电池的总反应可表示为Li+MnO2=LiMnO2,在此反应中锂元素的化合价变化0→+1,在LiMnO2中,氧元素显-2价,根据在化合物中正负化合价代数和为零,可知LiMnO2中锰元素的化合价:+3,则锰元素的化合价变化为+4→+3;
故选A.
点评 本题考查了原电池原理的应用和化合价的判断,题目难度不大,侧重于基础知识的考查,注意根据化合价的代数和为零分析.

练习册系列答案
相关题目
16.下列叙述错误的是( )
| A. | 通常情况下,甲烷和强酸、强碱、强氧化剂不起反应 | |
| B. | 光照下甲烷与氯气发生取代反应 | |
| C. | 甲烷的氯代物CHCl3、CCl4都难溶于水 | |
| D. | 甲烷在光照条件下与氧气反应 |
17.分子式C9H10O2的有机物,其结构中含有苯环且可以与饱和NaHCO3溶液反应放出气体的同分异构体有(不考虑立体异构)( )
| A. | 12种 | B. | 13种 | C. | 14种 | D. | 15种 |
14.某元素R,其原子最外层比次外层多一个电子,则其含氧酸的化学式不可能是( )
| A. | HRO2 | B. | H3RO3 | C. | H2RO4 | D. | H2R4O7 |
1.已知反应3O2(g)=2O3(g)的△H<0、△S<0,对此反应叙述正确的是( )
| A. | 该反应在任何情况下均能自发进行 | |
| B. | 该反应在任何情况下均不能自发进行 | |
| C. | 该反应在一定条件下能自发进行 | |
| D. | 条件不足,无法判断 |
18.下列说法不正确的是( )
| A. | 某芳香烃的分子式为C10H14,不能使溴水因反应而褪色,苯环上只有一个取代基,符合条件的烃有4种 | |
| B. | 按照系统命名法,有机物 的命名为2,2,4,4,5-五甲基-3,3-二乙基己烷 的命名为2,2,4,4,5-五甲基-3,3-二乙基己烷 | |
| C. | 甲烷、甲醛、甲酸甲脂都不存在同分异构体 | |
| D. | 某有机物含有C、H、O、N四种元素,其球棍模型为 该有机物能发生取代反应 该有机物能发生取代反应 |
4.根据下列流程处理废旧电路板,回收金属M,并制得高效绿色净水剂K2EO4.
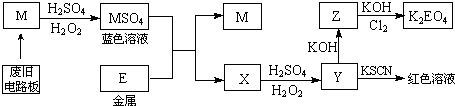
据此回答问题:
(1)M的化学式是Cu.
(2)M→MSO4过程中,氧化剂是H2O2,还原剂是Cu.
(3)写出Z→K2EO4的化学反应方程式:2Fe(OH)3+10KOH+3Cl2=2K2FeO4+8H2O+6KCl.
(4)向Y溶液中滴加KI淀粉溶液,变为蓝色,其原因用离子方程式解释为:2Fe3++2I-═2Fe2++I2.
(5)控制其他条件相同,印刷电路板的金属 M用10%H2O2和3.0mol/LH2SO4的混合溶液处理,测得不同温度下金属M的平均溶解速率(见下表).
当温度高于40℃时,M的平均溶解速率随着反应温度升高而下降,其主要原因是过氧化氢分解浓度降低造成速率减慢.

据此回答问题:
(1)M的化学式是Cu.
(2)M→MSO4过程中,氧化剂是H2O2,还原剂是Cu.
(3)写出Z→K2EO4的化学反应方程式:2Fe(OH)3+10KOH+3Cl2=2K2FeO4+8H2O+6KCl.
(4)向Y溶液中滴加KI淀粉溶液,变为蓝色,其原因用离子方程式解释为:2Fe3++2I-═2Fe2++I2.
(5)控制其他条件相同,印刷电路板的金属 M用10%H2O2和3.0mol/LH2SO4的混合溶液处理,测得不同温度下金属M的平均溶解速率(见下表).
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| V(M)(x10-3mol.L-1.min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |