题目内容
17.A、B、C、D四种短周期元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,B与C的单质在加热条件下反应,生成一种淡黄色的固体E;D的L层电子数等于K、M两个电子层上的电子数之和.(1)写元素符号:A为C,B为O.
(2)写出元素C在周期表中的位置第三周期第ⅠA族.
(3)D的最高价氧化物的水化物化学式是H2SO4.
(4)E属离子(“离子”或“共价”)化合物.E中含化学键为离子键、共价键.
(5)写出A、B形成的化合物与E反应的化学方程式:Na2O2+2CO2=2Na2CO3+O2.
(6)C与D两元素可形成化合物,用电子式表示其化合物的形成过程
 .
.
分析 A、B、C、D四种短周期元素,原子序数依次增大,B与C的单质在加热条件下反应,生成一种淡黄色的固体E,E为Na2O2,B的阴离子和C的阳离子具有相同的电子层结构,可知B为O,C为Na;A原子的最外层上有4个电子,A为第二周期ⅣA族元素,A为C;D的L层电子数等于K、M两个电子层上的电子数之和,M层电子数为8-2=6,可知D为S元素,以此来解答.
解答 解:由上述分析可知,A为C,B为O,C为Na,D为S,
(1)元素符号:A为C,B为O,故答案为:C;O;
(2)元素C在周期表中的位置为第三周期第ⅠA族,故答案为:第三周期第ⅠA族;
(3)D的最高价氧化物的水化物化学式是H2SO4,故答案为:H2SO4;
(4)E为Na2O2,含离子键、共价键,E属离子化合物,故答案为:离子;离子键、共价键;
(5)A、B形成的化合物与E反应的化学方程式为Na2O2+2CO2=2Na2CO3+O2,故答案为:Na2O2+2CO2=2Na2CO3+O2;
(6)C与D两元素可形成化合物Na2S,为离子化合物,用电子式表示其化合物的形成过程为 ,
,
故答案为: .
.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子序数、原子结构、元素化合物知识来推断元素为解答的关键,侧重分析与应用能力的考查,注意物质的性质及化学用语的应用,题目难度不大.

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
11.在一定的温度下,向一个容积为2L的恒容密闭容器中(事先装入催化剂),充入2molN2和3molH2,3min后测得密闭容器内的压强是起始时的0.9倍.在这段时间内,用H2表示该反应的平均反应速率是( )
| A. | 0.125mol•L-1•min-1 | B. | 0.100 mol•L-1•s-1 | ||
| C. | 0.200 mol•L-1•min-1 | D. | 0.375 mol•L-1•s-1 |
5.下列说法正确的是( )
| A. | 溶液是电中性的,胶体是带电的 | |
| B. | 溶液中溶质粒子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动 | |
| C. | 浓氨水中滴加饱和FeCl3溶液可制得氢氧化铁胶体 | |
| D. | 胶体不一定是液态,胶体的丁达尔效应属于物理变化 |
12.NA为阿伏加德罗常数,下列叙述正确的是( )
| A. | 1 mol苯分子中含有碳碳双键数为3NA | |
| B. | 常温下,0.1 mol乙烷与乙烯混合气体中所含碳原子数为0.2NA | |
| C. | 14 g乙烯和丙烯的混合气体中所含原子总数为2NA | |
| D. | 标准状况下,22.4 L己烷中共价键数目为19NA |
2.下列离子方程式正确的是( )
| A. | 过量铁粉溶于稀HNO3中:Fe+NO3-+4H+═Fe3++NO↑+2H2O | |
| B. | 过量NaHSO4溶液加入到Ba(OH)2溶液中:2H++SO42-+Ba2++2 OH-═2H2O+BaSO4↓ | |
| C. | 少量Cl2通人FeBr2溶液中:2 Br-+Cl2═2 Cl-+Br2 | |
| D. | 少量 AlCl3溶液滴入到氨水中:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
7.下列物质的分类正确的是( )
| A. | 氧化物:CO2、NO、SO2、H2O | |
| B. | 碱:NaOH、KOH、Ba(OH)2、Na2CO3 | |
| C. | 铵盐:NH4Cl、NH4NO3、(NH4)2SO4、NH3•H2O | |
| D. | 碱性氧化物:Na2O、CaO、Mn2O7、Fe2O3 |
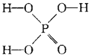 )子中的三个氢原子都可以与重水分子(对D2O)中的D原子发生氢交换.又知次磷酸(H3PO2)也可与D2O进行氢交换,但次磷酸钠(NaH2PO2)
)子中的三个氢原子都可以与重水分子(对D2O)中的D原子发生氢交换.又知次磷酸(H3PO2)也可与D2O进行氢交换,但次磷酸钠(NaH2PO2)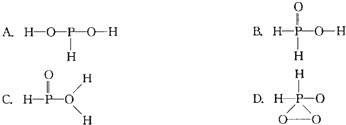
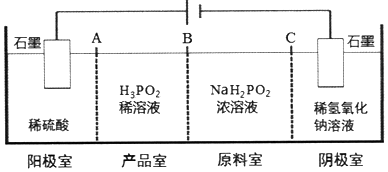

 (不考虑立体异构)
(不考虑立体异构)