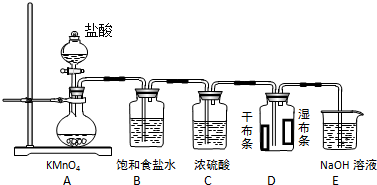
题目内容
16.α-松油醇的合成路线如下: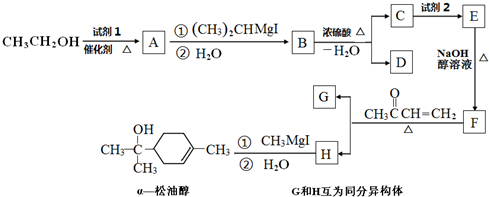
可供选择的试剂:①Br2 ②H2 ③O2
已知:
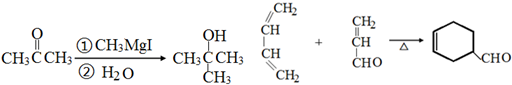
请回答:
(1)试剂1是O2,试剂2是Br2.
(2)A至H中,能发生银镜反应的是CH3CHO.
(3)D和G的结构简式分别是:DCH2=CHCH(CH3)2;G
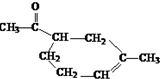 .
.(4)E转化为F的化学方程式是(CH3)2CBrCHBrCH3+2NaOH$→_{△}^{醇}$CH2=CH-C(CH3)=CH2+2NaBr+2H2O.
(5)F转化为H的化学方程式是
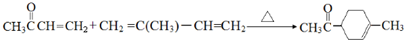 .
.
分析 由α-松油醇的结构、给予的反应信息,逆推可知H为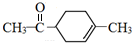 ,结合信息可知F为CH2=CH-C(CH3)=CH2,G与H互为同分异构体,则G为
,结合信息可知F为CH2=CH-C(CH3)=CH2,G与H互为同分异构体,则G为 .乙醇系列转化得到F,则乙醇与氧气发生催化氧化得到A为CH3CHO,由信息可知B为CH3CH(OH)CH(CH3)2,B发生消去反应得到C与D,C与溴发生加成反应得到E,E发生消去反应得到F,则D为CH2=CHCH(CH3)2,C为CH3CH=C(CH3)2,E为(CH3)2CBrCHBrCH3,据此解答.
.乙醇系列转化得到F,则乙醇与氧气发生催化氧化得到A为CH3CHO,由信息可知B为CH3CH(OH)CH(CH3)2,B发生消去反应得到C与D,C与溴发生加成反应得到E,E发生消去反应得到F,则D为CH2=CHCH(CH3)2,C为CH3CH=C(CH3)2,E为(CH3)2CBrCHBrCH3,据此解答.
解答 解:由α-松油醇的结构、给予的反应信息,逆推可知H为 ,结合信息可知F为CH2=CH-C(CH3)=CH2,G与H互为同分异构体,则G为
,结合信息可知F为CH2=CH-C(CH3)=CH2,G与H互为同分异构体,则G为 .乙醇系列转化得到F,则乙醇与氧气发生催化氧化得到A为CH3CHO,由信息可知B为CH3CH(OH)CH(CH3)2,B发生消去反应得到C与D,C与溴发生加成反应得到E,E发生消去反应得到F,则D为CH2=CHCH(CH3)2,C为CH3CH=C(CH3)2,E为(CH3)2CBrCHBrCH3.
.乙醇系列转化得到F,则乙醇与氧气发生催化氧化得到A为CH3CHO,由信息可知B为CH3CH(OH)CH(CH3)2,B发生消去反应得到C与D,C与溴发生加成反应得到E,E发生消去反应得到F,则D为CH2=CHCH(CH3)2,C为CH3CH=C(CH3)2,E为(CH3)2CBrCHBrCH3.
(1)由上述分析可知,试剂1是O2,试剂2是Br2,故答案为:O2;Br2;
(2)含有醛基的物质可以发生有机反应,A至H中能发生银镜反应的是:CH3CHO,故答案为:CH3CHO;
(3)D的结构简式为CH2=CHCH(CH3)2,G的结构简式为 ,
,
故答案为:CH2=CHCH(CH3)2; ;
;
(4)E转化为F的化学方程式是(CH3)2CBrCHBrCH3+2NaOH$→_{△}^{醇}$CH2=CH-C(CH3)=CH2+2NaBr+2H2O,
故答案为:(CH3)2CBrCHBrCH3+2NaOH$→_{△}^{醇}$CH2=CH-C(CH3)=CH2+2NaBr+2H2O;
(5)F转化为H的化学方程式是: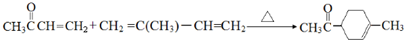 ,
,
故答案为: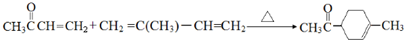 .
.
点评 本题考查有机物的推断与合成,根据有机物的结构与反应信息采取正逆推法相结合进行推断,需要学生熟练掌握官能团的结构与性质,较好的考查学生自学能力、知识迁移运用,难度中等.

| A. | 反应后溶液可能呈中性 | |
| B. | 反应停止后一定有固体剩余 | |
| C. | 反应过程中一定有氧化还原反应发生 | |
| D. | 若只有Cu剩余,向溶液中滴入铁氰化钾溶液不会产生蓝色沉淀 |
| 实验装置 | 编号 | 溶液X | 实验现象 |
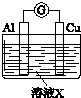 | 实验Ⅰ | 6mol•L-1稀硝酸 | 电流计指针向右偏转,铜片表面产生无色气体,在液面上方变为红棕色. |
| 实验Ⅱ | 15mol•L-1浓硝酸 | 电流计指针先向右偏转,很快又偏向左边,铝片和铜片表面产生红棕色气体,溶液变为绿色. |
(2)实验Ⅱ中电流计指针先偏向右边后偏向左边的原因是Al开始作电池的负极,Al在浓硝酸中迅速生成致密氧化膜后,Cu作负极.
查阅资料:活泼金属与1mol•L-1稀硝酸反应有H2和NH4+生成,NH4+生成的原理是产生H2的过程中NO3-被还原.
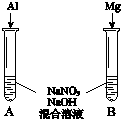 (3)用如图装置进行实验Ⅲ:溶液X为1mol•L-1稀硝酸溶液,观察到电流计指针向右偏转.
(3)用如图装置进行实验Ⅲ:溶液X为1mol•L-1稀硝酸溶液,观察到电流计指针向右偏转.①反应后的溶液中含NH4+.实验室检验NH4+的方法是取少量待检溶液于试管中,加入浓NaOH溶液,加热,若产生使湿润的红色石蕊试纸变蓝的气体,则溶液中含NH4+.
②生成NH4+的电极反应式是NO3-+8e-+10H+=NH4++3H2O.
(4)进一步探究碱性条件下NO3-的氧化性,进行实验Ⅳ:
①观察到A中有NH3生成,B中无明显现象.A、B产生不同现象的解释是Al与NaOH溶液反应产生H2的过程中可将NO3-还原为NH3,而Mg不能与NaOH.
②A中生成NH3的离子方程式是8Al+3NO3-+5OH-+2H2O=3NH3↑+8AlO2-.
(5)将铝粉加入到NaNO3溶液中无明显现象,结合实验Ⅲ和Ⅳ说明理由因为铝与中性的硝酸钠溶液无生成H2的过程,NO3-无法被还原.
| A. | 水 | B. | 新制Cu(OH)2 | C. | NaOH溶液 | D. | 石蕊试剂 |
(1)分别向浓度均为0.1mol/LNa2CO3及NaHCO3溶液中滴加几滴酚酞试剂:
①Na2CO3溶液由无色变为红色,其原因是CO32-+H2O?HCO3-+OH-.
②NaHCO3溶液也由无色变为红色,其原因是HCO3-+H2O?H2CO3+OH-,HCO3-?H++CO32-,水解程度大于电离程度.
③比较两份溶液的颜色,红色较浅的是NaHCO3(填化学式).
(2)研究NaHCO3与CaCl2的反应.
| 实验序号 | 实验操作 | 实验现象 |
| 实验1 | 向2mL 0.001mol/L NaHCO3溶液中加入1mL 0.1mol/LCaCl2溶液 | 无明显变化.用激光笔照射,没有出现光亮的通路. |
| 实验2 | 向2mL 0.1mol/L NaHCO3溶液中加入1mL 0.1mol/LCaCl2溶液 | 略显白色均匀的浑浊,用激光笔照射,出现光亮的通路. |
②实验2中形成的分散系属于胶体.
③用离子方程式表示实验2中发生的反应Ca2++2HCO3-=CaCO3↓+CO2+H2O.
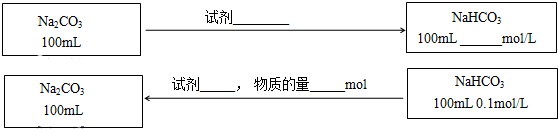
(3)在不引入其他杂质的前提下,实现Na2CO3与NaHCO3之间的转化,请在图中标出所用的试剂、用量或物质的浓度(反应前后溶液体积的变化可忽略).
| A. | 2Fe+4H2O═Fe2O3+4H2 | B. | 3NO2+H2O═2HNO3+NO | ||
| C. | Ca(OH)2+SO2═CaSO3+H2O | D. | Cu+2H2SO4(浓)═CuSO4+SO2↑+2H2O |