题目内容
9.蛋白质缺乏是可以致命的.人体内蛋白质约占体重的16%.一个体重为60kg的人,体内含有10~11kg的蛋白质.如果人体丢失体内20%以上的蛋白质,生命活动有可能会被迫停止.常见的蛋白质缺乏症表现为代谢下降,生命变得脆弱易病.蛋白质的生理功能与它的化学性质密切相关.人体摄入的蛋白质,在酶的催化作用下发生水解,最终生成氨基酸.这些氨基酸一部分重新合成人体所需的蛋白质、糖或脂类物质,以满足各种生命活动的需要;另一部分则发生氧化反应,释放能量.①蛋白质分子中主要含有C、H、O、N四种元素.
②蛋白质水解最终得到α-氨基酸.
③蛋白质溶液遇到浓的硫酸铵等无机盐溶液,会析出沉淀;再加适量水后,蛋白质重新溶解,仍然具有原来的活性.这个过程称为盐析.
④人体中共有二十多种氨基酸,其中有几种是人体自身不能合成的,必须由食物获得,称为必需氨基酸.
分析 ①蛋白质是由C(碳)、H(氢)、O(氧)、N(氮)组成;
②天然蛋白质是α-氨基酸形成的;
③盐析一般是指溶液中加入无机盐类而使某种物质溶解度降低而析出的过程;
④必需氨基酸指的是人体自身不能合成或合成速度不能满足人体需要,必须从食物中摄取的氨基酸.
解答 解:①蛋白质是由C(碳)、H(氢)、O(氧)、N(氮)组成,一般蛋白质可能还会含有P、S、Fe(铁)、Zn(锌)、Cu(铜)等,故答案为:C、H、O、N;
②天然蛋白质水解的最终产物是α-氨基酸,故答案为:α-氨基酸;
③蛋白质溶液遇到浓的硫酸铵等无机盐溶液发生盐析,故答案为:盐析;
④必需氨基酸指的是人体自身不能合成或合成速度不能满足人体需要,必须从食物中摄取的氨基酸.故答案为:必需.
点评 本题主要考查蛋白质的性质,难度较小,旨在考查学生对基础知识的识记,注意基础知识的积累掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5. 50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题:
50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题:
(1)如果将环形玻璃搅拌棒改为环形金属(如铜)棒,对求得中和热数值的影响是偏低(填“偏高”、“偏低”或“无影响”).
(2)如果改用60mL 1.0mol•L-1盐酸跟50mL 1.1mol•L-1氢氧化钠溶液进行反应,则与上述实验相比,所放热量增加(填“增加”、“减少”或“不变”),所求中和热数值不变(填“增加”、“减少”或“不变”);
(3)不能用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液,理由是硫酸与Ba(OH)2溶液反应生成BaSO4沉淀的生成热会影响反应的反应热;;
(4)该实验小组做了三次实验,每次取溶液各50mL,并记录如下原始数据.
已知盐酸、NaOH溶液密度近似为1.00g/cm3,中和后混合液的比热容C=4.184×10-3 kJ/(g.℃),则该反应的中和热为△H=-56.5kJ/mol(保留小数点后一位).
(5)上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是acd(填字母).
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度.
 50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题:
50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题:(1)如果将环形玻璃搅拌棒改为环形金属(如铜)棒,对求得中和热数值的影响是偏低(填“偏高”、“偏低”或“无影响”).
(2)如果改用60mL 1.0mol•L-1盐酸跟50mL 1.1mol•L-1氢氧化钠溶液进行反应,则与上述实验相比,所放热量增加(填“增加”、“减少”或“不变”),所求中和热数值不变(填“增加”、“减少”或“不变”);
(3)不能用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液,理由是硫酸与Ba(OH)2溶液反应生成BaSO4沉淀的生成热会影响反应的反应热;;
(4)该实验小组做了三次实验,每次取溶液各50mL,并记录如下原始数据.
| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | 温差(t2-t1)/℃ |
| 1 | 25.0 | 32.6 | |
| 2 | 25.1 | 31.8 | |
| 3 | 25.1 | 31.9 |
(5)上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是acd(填字母).
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度.
3.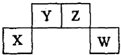 短周期元素X、Y、Z、W在周期表中的位置关系如图,X元素的单质既能与强酸反应,又能与强碱反应.下列说法正确的是( )
短周期元素X、Y、Z、W在周期表中的位置关系如图,X元素的单质既能与强酸反应,又能与强碱反应.下列说法正确的是( )
 短周期元素X、Y、Z、W在周期表中的位置关系如图,X元素的单质既能与强酸反应,又能与强碱反应.下列说法正确的是( )
短周期元素X、Y、Z、W在周期表中的位置关系如图,X元素的单质既能与强酸反应,又能与强碱反应.下列说法正确的是( )| A. | 常温下X的单质投入浓硫酸中没有明显现象 | |
| B. | Y的氢化物只有一种 | |
| C. | W的氧化物对应的水化物一定是强酸 | |
| D. | Z的氧化物排放不会造成环境污染 |
14.已知热的氢氧化钾溶液与Cl2可发生如下反应:6KOH+3Cl2═5KCl+KClO3+3H2O则下列说法中正确的是( )
| A. | 该反应中氯气既是氧化剂又是还原剂 | |
| B. | KCl既是氧化产物又是还原产物 | |
| C. | 该反应中的氧化剂只有KOH | |
| D. | 氧化产物与还原产物物质的量之比为5:1 |
1.CuI是一种白色不溶于水的固体,以石墨(阴)和铜(阳)为电极组成电解槽,以含酚酞和淀粉的KI水溶液为电解液进行电解.电解开始不久,阴极区溶液显红色,而阳极区仍为无色.过了相当长的时间后,阳极区才呈蓝色,则电解开始时的电极反应为( )
| A. | 阳极反应:Cu-2e-═Cu2+ 阴极反应:Cu2++2e-═Cu | |
| B. | 阳极反应:2Cu-2e-+2I-═2CuI 阴极反应:2H++2e-═H2↑ | |
| C. | 阳极反应:2I--2e-═I2 阴极反应:2H++2e-═H2↑ | |
| D. | 阳极反应:Cu-2e-═Cu2+ 阴极反应:2H++2e-═H2↑ |
18.在酸性溶液中能大量共存而且为无色透明的溶液是( )
| A. | NH4+、Al3+、CO32-、NO3- | B. | K+、Na+、NO3-、SO42- | ||
| C. | K+、MnO4-、NH4+、NO3- | D. | Na+、K+、HCO3-、NO3- |
19.用50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液,在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
(1)该实验中,量取50mL盐酸或NaOH溶液,需要用到的仪器有50mL量筒和胶头滴管;
(2)某同学实验记录的数据如上表所示,其中记录的终止温度是指全反应后混合溶液的最高温度;
(3)计算该实验发生中和反应时放出的热量为1344J[中和后生成的溶液的比热容c=4.2J•(g•℃)-1,稀溶液的密度都为1g•cm-3];
(4)上述实验数值结果与57.3kJ•mol-1有偏差,产生偏差的原因可能是(填字母)acd.
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度起始温度
(5)若改用60mL0.5mol•L-1盐酸跟50mL0.55mol•L-1氢氧化钠进行反应,实验操作均正确,与上述实验相比,所求的中和热相等(填相等或不相等).
| 起始温度t1/℃ | 终止温度t2/℃ | 温度差 (t2-t1)/℃ | |||
| HCl | NaOH | 平均值 | |||
| 1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
| 2 | 24.5 | 24.2 | 24.45 | 27.6 | 3.15 |
| 3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
(2)某同学实验记录的数据如上表所示,其中记录的终止温度是指全反应后混合溶液的最高温度;
(3)计算该实验发生中和反应时放出的热量为1344J[中和后生成的溶液的比热容c=4.2J•(g•℃)-1,稀溶液的密度都为1g•cm-3];
(4)上述实验数值结果与57.3kJ•mol-1有偏差,产生偏差的原因可能是(填字母)acd.
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度起始温度
(5)若改用60mL0.5mol•L-1盐酸跟50mL0.55mol•L-1氢氧化钠进行反应,实验操作均正确,与上述实验相比,所求的中和热相等(填相等或不相等).