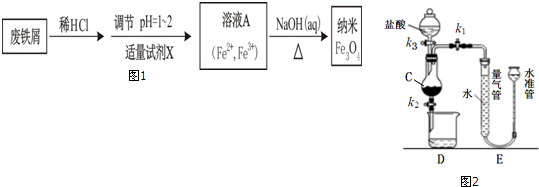
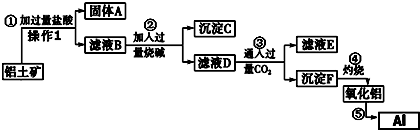
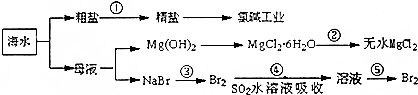
题目内容
5. 室温下,用某浓度NaOH溶液滴定一元酸HA的滴定曲线如图所示(横坐标为滴入NaOH的体积,纵坐标为所得混合液的pH).下列判断正确的是
室温下,用某浓度NaOH溶液滴定一元酸HA的滴定曲线如图所示(横坐标为滴入NaOH的体积,纵坐标为所得混合液的pH).下列判断正确的是( )
| A. | HA的浓度为1×10-4mol•L-1 | B. | 实验时可选甲基橙作指示剂 | ||
| C. | pH=7时,溶液中c(Na+)>c(A-) | D. | V=10mL,酸碱恰好中和 |
分析 A.HA是弱酸,不完全电离,结合图象判断氢离子浓度,然后分析HA的浓度大小;
B.氢氧化钠和弱酸反应恰好反应生成的盐是强碱弱酸盐,盐水解显碱性,应选择碱性条件下变色的指示剂;
C.根据溶液中的电荷守恒判断;
D.由图象可知,当V=10mL,酸碱恰好中和.
解答 解:A.由图象分析可知,c(H+)=1×10-4mol•L-1,由于HA是弱酸,不完全电离,所以HA的浓度为大于1×10-4mol•L-1,故A错误;
B.氢氧化钠和弱酸反应恰好反应生成的盐是强碱弱酸盐,盐水解显碱性,应选择碱性条件下变色的指示剂,不能选择甲基橙,应选择酚酞指示剂,故B错误;
D.pH=7时,c(H+)=c(OH-),根据电荷守恒可知:c(Na+)=c(A-),故C错误;
D.由图象可知,当V=10mL曲线出现飞跃,说明酸碱恰好中和,故D正确;
故选D.
点评 本题考查酸碱混合的定性判断和计算,题目难度中等,本题注意把握弱电解质的电离特点,易错点为D,注意酸碱中和滴定的实验原理,试题培养了学生灵活应用基础知识的能力.

练习册系列答案
相关题目
11.X、Y、Z、W、R属于短周期主族元素.X的原子半径在短周期主族元素中最大,Y元素的原子最外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数为m-n,W元素与Z元素同主族,R元素原子与Y元素原子的核外电子数之比为2:1.下列叙述正确的是( )
| A. | 原子半径由大判小的顺序;Z>R>Y>W | |
| B. | X与Y形成化合物中一定含有离子键,可能含有共价键 | |
| C. | Y的氢化物比R的氢化物稳定,但Y的氢化物比R的氢化物熔沸点低 | |
| D. | RY2、WY2通入BaCl2溶液中均有白色沉淀生成. |
20.在0.1mol•L-1氨水中存在如下电离平衡:NH3•H2O?NH4++OH-,对于该平衡,下列叙述正确的是( )
| A. | 加入水时,溶液中c(OH-) 增大 | |
| B. | 加入少量NH4Cl固体,平衡向逆方向移动,电离平衡常数减小 | |
| C. | 通入少量HCl气体,溶液中c(NH4+)增大 | |
| D. | 降低温度,促进NH3•H2O电离 |
10.下列不属于我国“城市空气质量日报”报道内容的是( )
| A. | SO2 | B. | CO2 | C. | PM2.5 | D. | 空气质量等级 |
17.人们对原子结构的认识有一个不断深入的过程,下列先后顺序中符合史实的是( )
①道尔顿提出的原子论②卢瑟福的原子结构行星模型③玻尔提出的原子力学模型④汤姆孙提出的葡萄干面包原子模型.
①道尔顿提出的原子论②卢瑟福的原子结构行星模型③玻尔提出的原子力学模型④汤姆孙提出的葡萄干面包原子模型.
| A. | ①②③④ | B. | ①③②④ | C. | ②①④③ | D. | ①④②③ |