题目内容
20.曲线a和b是常温下盐酸与氢氧化钠溶液相互滴定的滴定曲线,下列叙述中正确的是( )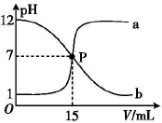
| A. | 盐酸的物质的量浓度与NaOH溶液的物质的量浓度相等 | |
| B. | P点时溶液中c(Na+)=c(Cl-)=c(H+)=c(OH-) | |
| C. | 曲线a是盐酸滴定氢氧化钠溶液的滴定曲线 | |
| D. | 曲线b中滴定前NaOH溶液的体积为150mL |
分析 A.根据图知,未加其它溶液时,a曲线的pH=1,该溶液中溶质为HCl,且c(HCl)=0.1mol/L,b曲线的pH=12,该溶液的溶质为NaOH,且c(NaOH)=0.01mol/L;
B.P点溶液呈中性,则溶液中c(H+)=c(OH-),根据电荷守恒得c(Na+)=c(Cl-),混合溶液中溶质为NaCl,且该混合溶液中水电离程度很小,据此判断c(Cl-)、c(H+)相对大小;
C.曲线a中,未滴加另一种溶液时,该溶液的pH<7,说明溶液中溶质为酸,则为碱滴定酸的曲线;
D.b中完全中和时消耗盐酸15mL,且P点酸碱恰好完全反应,二者的物质的量相等,据此计算NaOH溶液体积.
解答 解:A.根据图知,未加其它溶液时,a曲线的pH=1,该溶液中溶质为HCl,且c(HCl)=0.1mol/L,b曲线的pH=12,该溶液的溶质为NaOH,且c(NaOH)=0.01mol/L,所以盐酸浓度是NaOH浓度的10倍,故A错误;
B.P点溶液呈中性,则溶液中c(H+)=c(OH-),根据电荷守恒得c(Na+)=c(Cl-),混合溶液中溶质为NaCl,且该混合溶液中水电离程度很小,所以溶液中c(Cl-)>c(H+),则溶液中离子浓度大小顺序是c(Na+)=c(Cl-)>c(H+)=c(OH-),故B错误;
C.曲线a中,未滴加另一种溶液时,该溶液的pH<7,说明溶液中溶质为酸,则为碱滴定酸的曲线,即NaOH滴定盐酸的曲线,故C错误;
D.b中完全中和时消耗盐酸15mL,且P点酸碱恰好完全反应,二者的物质的量相等,V(NaOH)=$\frac{0.1mol/L×0.015L}{0.01mol/L}$=150mL,故D正确;
故选D.
点评 本题考查中和滴定、溶液中离子浓度大小比较,为高频考点,试题借助于滴定曲线考查了中和滴定过程中PH的变化,注意掌握比较溶液中离子浓度大小的方法,题目难度不大.

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案| A. | 某物质不属电解质,就属于非电解质 | |
| B. | SO3溶于水可导电,SO3属于电解质 | |
| C. | 能导电的物质属于电解质,NaCl属于电解质,NaCl晶体可导电 | |
| D. | 已知氧化铝在熔融状态下能导电,则氧化铝在熔融状态下能电离 |
 下表给出五种元素的相关信息,根据以下信息填空:
下表给出五种元素的相关信息,根据以下信息填空:| 元素 | 相关信息 |
| T | 基态原子2p能级有3个单电子 |
| W | 基态原子p轨道上成对电子数等于未成对电子数 |
| X | 氢化物常用于刻蚀玻璃 |
| Y | 基态原子核外电子分处6个不同能级,且每个能级均已排满 |
| Z | 原子序数等于X与Y的原子序数之和 |
(2)42gT的单质分子中π键的个数为3NA;在T的最简单氢化物分子中T原子的杂化类型是sp3.研究者预想合成一个纯粹由T元素组成的新物种T5+T3-,若T5+离子中每个氮原子均满足8电子且呈对称结构,以下有关T5+推测正确的是BD(填序号)
A.N5+有24个电子
B.N5+阳离子中存在两个氮氮三键
C.N5+离子中存在三对未成键的电子对
D.N3-离子的空间构型为直线型
(3)TX3是一种无色、无味、无毒且不可燃的气体,在半导体加工,太阳能电池制造和液晶显示器制造中得到广泛应用.它可在Z单质的催化作用下由X2和过量的TH3反应得到,试写出该反应的化学方程式:4NH3+3F2$\frac{\underline{\;Cu\;}}{\;}$NF3+3NH4F.在该反应方程式中的几种物质所属的晶体类型有acd(填序号).
a.离子晶体 b.原子晶体 c.分子晶体 d.金属晶体
(4)T、W、X 3种元素的电负性由大到小的顺序为F>O>N(用元素符号表示).
(5)Z2+能与T的氢化物写出配位数为4的配离子[Z(TH3)4]2+,该配离子具有对称的空间构型,且离子中的两个TH3被两个Cl取代只能得到一种产物,则[Z(TH3)4]2+的空间构型为正四面体.
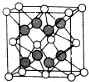
(6)X和Y形成的化合物的晶胞结构如图所示,已知晶体的密度为ρ g•cm-3,阿伏加德罗常数为NA,则晶胞边长a=$\root{3}{\frac{312ρ}{{N}_{A}}}$cm.(用ρ、NA的计算式表示).
| A. | 摩尔是国际单位制中的七大基本物理量之一 | |
| B. | 1 mol任何物质都约含有6.02×1023个原子 | |
| C. | 以克为单位时,2 mol水的摩尔质量是1 mol水的摩尔质量的2倍 | |
| D. | 在同温同压下,气体所占的体积主要由气体分子的物质的量决定 |
| A. | 常温下,0.1 mol•L-1Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+2c(H2S) | |
| B. | 常温下,0.1 mol•L-1HA溶液与0.1 mol•L-1 NaOH溶液正好完全反应时,溶液中一定存在:c(Na+)=c(A-)>c(OH-)=c(H+) c(CH3COO-)c(CH3COOH) | |
| C. | 常温下,向0.1 mol•L-1CH3COOH 溶液加水稀释,当溶液的pH从3.0升到4.0时,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的值增大到原来的10倍 | |
| D. | 常温下,pH=7的CH3COONa和CH3COOH混合溶液中c(Na+)=0.1 mol•L-1:c(Na+)=c(CH3COOH)>c(CH3COO-)>c(H+)=c(OH-) |
| A. | v(W)=3v(Z) | B. | 2v(X)=3v(Z) | C. | 2v(X)=v(Y) | D. | 2v(W)=3v(X) |
 .
.