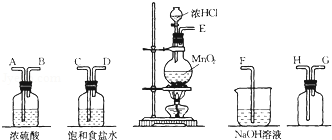
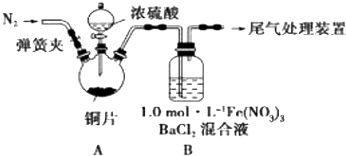
题目内容
15.在一可变容积的密闭容器中进行反应:C(s)+H2O(g)?CO(g)+H2(g),下列条件的改变对反应速率几乎无影响的是( )| A. | 增加H2O(g) 的量 | |
| B. | 增加C(s)的量 | |
| C. | 将容器的体积缩小一半 | |
| D. | 保持压强不变,充入N2,使容器的体积变大 |
分析 该反应是反应前后气体体积增大的可逆反应,温度、气体物质浓度、催化剂、压强都影响反应速率,以此解答该题.
解答 解:A.增加H2O(g) 的量,气体浓度增大,反应速率增大,故A不选;
B.C是固体,增加C的用量,浓度不变,不影响反应速率,故B选;
C.将容器的体积缩小一半,气体物质浓度增大,反应速率增大,故C不选;
D.保持压强不变,充入N2使体系体积增大,参加反应的气体的浓度减小,反应速率减小,故D不选.
故选B.
点评 本题考查化学反应速率的因素,为高考高频考点,侧重于学生的分析能力和基础知识的考查,有利于化学科学素养的培养和提高学生学习的积极性,难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
6.在反应11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中,1molCuSO4能氧化P的物质的量为( )
| A. | $\frac{11}{15}$ mol | B. | $\frac{2}{5}$mol | C. | $\frac{3}{5}$mol | D. | $\frac{1}{5}$ mol |
3.将饱和FeCl3溶液滴入沸水并煮沸一段时间,可得到红褐色液体,此液体不具有的性质是( )
| A. | 光束通过该液体时形成光亮的“通路” | |
| B. | 插入石墨电极通直流电后,有一极附近液体颜色加深 | |
| C. | 向该液体中加入硝酸银溶液,无沉淀产生 | |
| D. | 向该液体中逐滴滴入过量的稀硫酸,会看到液体先生成红褐色沉淀,后沉淀溶解 |
10.羟基是一种重要的官能团.某化学兴趣小组以①碳酸 ②苯酚 ③乙酸3种物质的溶液作为研究
对象,通过实验来比较不同物质的羟基中氢原子的活泼性.
某同学设计并实施了如下实验方案,请完成有关填空.
对象,通过实验来比较不同物质的羟基中氢原子的活泼性.
某同学设计并实施了如下实验方案,请完成有关填空.
| 编号 | 实验操作 | 实验现象 | 结论及解释 |
| 1 | 分别取3种溶液,滴加紫色石蕊溶液 | 溶液会变红的是①③ | |
| 2 | 用足量的乙酸溶液浸泡碳酸钙 | 有关反应的化学方程式为CaCO3+2CH3COOH=Ca(CH3COO)2+H2O+CO2↑ | |
| 3 | 将CO2通入苯酚钠溶液中 | 有关反应的离子方程式为C6H5O-+CO2+H2O→C6H5OH+NHCO3- | |
| 结论:3种物质的羟基中的氢原子的活泼性由强到弱的顺序是③①②(填序号) | |||
20.下列高聚物是由两种单体缩聚而成的是( )
| A. |  | B. |  | ||
| C. |  | D. |  |
4.下列的描述中不正确的是( )
| A. | 常温下,pH=1的醋酸溶液中,醋酸分子的数目一定大于0.1mol | |
| B. | 一定条件下的可逆反应,反应物的转化率不可能达到100% | |
| C. | 沉淀溶解转换的实质是沉淀溶解平衡的移动,平衡一般向生成更难溶物质的方向移动 | |
| D. | △H<0,△S>0的反应一定是自发进行的化学反应 |
 2,3-二甲基戊烷;
2,3-二甲基戊烷; 3,5-二甲基-4-乙基-3-己烯.
3,5-二甲基-4-乙基-3-己烯. .
.