题目内容
14.有同学研究从矿石开始到产出钢铁的工艺流程.(1)将6.62g铁矿石样品投入足量的盐酸中完全溶解后过滤,滤渣中不含铁元素.在滤液中加过量的NaOH溶液,充分反应,过滤、洗涤、灼烧得4.80g Fe2O3,求该铁矿石含铁的质量分数.
(2)现以该铁矿石为原料炼铁,若生产过程中铁元素损失4%,计算每生产1.00吨生铁(含铁96%),至少需要这种铁矿石多少吨?(保留两位小数)
(3)取某钢样粉末28.12g(假设只含Fe和C),在氧气流中充分反应,得到CO2气体224mL(标准状况).计算此钢样粉末中铁和碳的物质的量之比.
(4)再取三份不同质量的上述钢样粉末,分别加到100mL相同浓度的H2SO4溶液中,充分反应后,测得的实验数据如下表所示:
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 加入钢样粉末的质量/g | 2.812 | 5.624 | 8.436 |
| 生成气体的体积/L(标准状况) | 1.120 | 2.240 | 2.800 |
(5)若在实验Ⅱ中继续加入mg钢样粉末,计算反应结束后剩余的固体质量为多少?(用含m的代数式表示)
分析 (1)4.80gFe中m(Fe)=4.80g×$\frac{112}{160}$=3.36(g),该铁矿石中含铁的质量分数=$\frac{m(Fe)}{矿石质量}×100%$;
(2)设铁矿石的质量为x,x×$\frac{3.36g}{6.62g}×100%$×(1-4%)=1.00t×96%,据此计算铁矿石质量;
(3)n(C)=0.224L÷22.4L•mol-1=0.010mol
m(C)=0.010mol×l2g•mol-1=0.12g
n(Fe)=$\frac{28.12g-0.12g}{56g/mol}$=0.5mol;
(4)根据表中数据知,II中固体质量是I的2倍,生成气体体积是I的2倍,说明硫酸可能恰好完全反应也可能没有完全反应,III中固体质量是I的3倍,但生成气体体积小于I的3倍,说明III中硫酸完全反应,根据氢气体积计算硫酸的物质的量,根据c=$\frac{n}{V}$计算硫酸物质的量浓度;
(5)根据样品中铁是否完全溶解分析,剩余固体还包含碳的质量.
解答 解:(1)4.80gFe中m(Fe)=4.80g×$\frac{112}{160}$=3.36(g),该铁矿石中含铁的质量分数=$\frac{m(Fe)}{矿石质量}×100%$=$\frac{3.36g}{6.62g}×100%$=51%,
答:该铁矿石含铁的质量分数为51%;
(2)设铁矿石的质量为x,x×$\frac{3.36g}{6.62g}×100%$×(1-4%)=1.00t×96%,x=$\frac{1.00×96%}{\frac{3.36g}{6.62g}×100%×(1-4%)}$=1.97t,
答:至少需要这种铁矿石1.97t;
(3)n(C)=0.224L÷22.4L•mol-1=0.010mol
m(C)=0.010mol×l2g•mol-1=0.12g
n(Fe)=$\frac{28.12g-0.12g}{56g/mol}$=0.5mol,
则n(Fe):n(C)=0.5mol:0.010mol=50:1
答:该样品中Fe、C的物质的量之比为50:1;
(4)根据表中数据知,II中固体质量是I的2倍,生成气体体积是I的2倍,说明硫酸可能恰好完全反应也可能没有完全反应,III中固体质量是I的3倍,但生成气体体积小于I的3倍,说明III中硫酸完全反应,
根据实验Ⅲ可得:
Fe+H2SO4=FeSO4+H2↑
1 mol 22.4L
n(H2SO4) 2.800L
n(H2SO4)=0.125mol
c(H2SO4)=0.125mol÷0.1L=1.25mol•L-1
答:硫酸的物质的量浓度是1.25mol/L;
(5)当钢样粉末中的铁未全部溶解时(m>1.406g),
剩余的固体质量为:(5.624g+mg)-0.125mol×56g•mol-1=(m-1.376)g
当钢样粉末中的铁全部溶解时(m≤1.406g),
剩余的固体质量为:(5.624+m)g×$\frac{0.12g}{28.12g}$=$\frac{(5.624+m)×0.12}{28.12}$g
答:当铁未完全溶解时,剩余固体的质量为(m-1.376)g;当铁完全溶解时,剩余固体的质量为$\frac{(5.624+m)×0.12}{28.12}$g.
点评 本题考查质量分数的计算及根据方程式的计算,为高频考点,侧重考查学生分析计算能力,明确各个物理量之间的关系是解本题关键,注意(4)中三个实验的分析,题目难度中等.

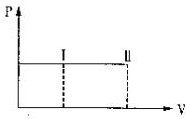 一带有活塞的密封容器中盛有A、B组成的混合气体,在通常条件下,从状态I反应到状态II时,气体体积(V)与气体压强(P)的变化曲线如图所示.
一带有活塞的密封容器中盛有A、B组成的混合气体,在通常条件下,从状态I反应到状态II时,气体体积(V)与气体压强(P)的变化曲线如图所示.则反应:A(g)+B(g)=2C(g)( )
| A. | 是放热反应 | |
| B. | 反应后气体总分子数增多 | |
| C. | 是吸热反应 | |
| D. | 反应物具有的总能量等于生成物具有的总能量 |
| A. | 盐酸、水煤气、醋酸、干冰 | B. | 液氯、氯水、硫酸钠、乙醇 | ||
| C. | 空气、天然气、苛性钾、硫酸钡 | D. | 胆矾、漂白粉、氯化钾、氯气 |
| A. | 酚酞溶液 | B. | 硝酸银溶液和稀硝酸 | ||
| C. | 盐酸溶液 | D. | 氯化钡溶液和稀盐酸 |
| A. | $\frac{11}{15}$ mol | B. | $\frac{2}{5}$mol | C. | $\frac{3}{5}$mol | D. | $\frac{1}{5}$ mol |
| A. | 光束通过该液体时形成光亮的“通路” | |
| B. | 插入石墨电极通直流电后,有一极附近液体颜色加深 | |
| C. | 向该液体中加入硝酸银溶液,无沉淀产生 | |
| D. | 向该液体中逐滴滴入过量的稀硫酸,会看到液体先生成红褐色沉淀,后沉淀溶解 |
| A. | 常温下,pH=1的醋酸溶液中,醋酸分子的数目一定大于0.1mol | |
| B. | 一定条件下的可逆反应,反应物的转化率不可能达到100% | |
| C. | 沉淀溶解转换的实质是沉淀溶解平衡的移动,平衡一般向生成更难溶物质的方向移动 | |
| D. | △H<0,△S>0的反应一定是自发进行的化学反应 |
 水是生命之源,它与我们的生活密切相关.在化学实验和科学研究中,水也是一种常用的试剂.
水是生命之源,它与我们的生活密切相关.在化学实验和科学研究中,水也是一种常用的试剂.