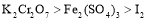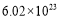题目内容
(14分)由软锰矿(主要成分为MnO2)制备KMnO4的实验流程可表示如下:

(1)反应Ⅰ发生反应的化学方程式是 ;
反应Ⅱ发生反应的离子方程式是 ;
(2)操作Ⅲ的实验步骤为 、 ;可循环利用的物质的化学式为 ;
(3)计算用2.5kg含MnO280%的软锰矿制备,理论上可得KMnO4为 :
(4)取制得的产品6.5g,配成250mL溶液;准确称取纯Na2C2O41.34g配成适量溶液。用上述KMnO4溶液滴定Na2C2O4溶液,恰好反应(氧化产物为CO2,还原产物为Mn2+)时,消耗KMnO4溶液的体积为25.00mL。该KMnO4的纯度为 %(保留小树点后一位)。
(1)3MnO2+KClO3+6KOH
 3K2MnO4+KCl+3H2O. (2分)
3K2MnO4+KCl+3H2O. (2分)
3MnO42-+4H+=MnO2↓+2MnO4-+2H2O (2分)
(2)浓缩(2分) 结晶(2分) MnO2 (2分)
(3)2.4kg (2分)
(4)97.2% (2分)
【解析】
试题分析:(1)根据题给流程知,KOH、KClO3、MnO2共熔制得K2MnO4、KCl,由原子守恒可知,还会生成H2O,反应方程式为:3MnO2+KClO3+6KOH 3K2MnO4+KCl+3H2O;由流程图可知,操作Ⅰ的滤液酸化生成高锰酸钾与二氧化锰,应是锰酸根与氢离子反应生成二氧化锰与高锰酸根离子,同时生成水,反应方程式为:3MnO42-+4H+=MnO2↓+2MnO4-+2H2O;(2)操作Ⅲ是从溶液中获得高锰酸钾晶体,应采取加热蒸发、冷却结晶等操作;操作Ⅱ的滤渣中含有二氧化锰,可以在反应Ⅰ中循环利用;(3)根据反应Ⅰ、Ⅱ,可以得出关系式3MnO2——2KMnO4,令理论上可得KMnO4为x kg,则87×3:2×158=2.5kg×80%:xkg,解得:x=2.4;(4)发生反应2KMnO4+5Na2C2O4+8H2SO4
3K2MnO4+KCl+3H2O;由流程图可知,操作Ⅰ的滤液酸化生成高锰酸钾与二氧化锰,应是锰酸根与氢离子反应生成二氧化锰与高锰酸根离子,同时生成水,反应方程式为:3MnO42-+4H+=MnO2↓+2MnO4-+2H2O;(2)操作Ⅲ是从溶液中获得高锰酸钾晶体,应采取加热蒸发、冷却结晶等操作;操作Ⅱ的滤渣中含有二氧化锰,可以在反应Ⅰ中循环利用;(3)根据反应Ⅰ、Ⅱ,可以得出关系式3MnO2——2KMnO4,令理论上可得KMnO4为x kg,则87×3:2×158=2.5kg×80%:xkg,解得:x=2.4;(4)发生反应2KMnO4+5Na2C2O4+8H2SO4 K2SO4+2MnSO4+5Na2SO4+10CO2↑+8H2O,令KMnO4的纯度为y,根据2KMnO4——5Na2C2O4代入题给数据计算 2×158:5×134=6.5g×y×0.1:1.34g解得y=97.2%。
K2SO4+2MnSO4+5Na2SO4+10CO2↑+8H2O,令KMnO4的纯度为y,根据2KMnO4——5Na2C2O4代入题给数据计算 2×158:5×134=6.5g×y×0.1:1.34g解得y=97.2%。
考点:以化学工艺流程为载体考查化学方程式、离子方程式的书写,化学实验基本操作,化学计算。

 名校课堂系列答案
名校课堂系列答案下列有关物质性质、结构的表述均正确,且存在因果关系的是
表述Ⅰ | 表述Ⅱ | |
A | 在形成化合物时,同一主族元素的化合价相同 | 同一主族元素原子的最外层电子数相同 |
B | 在水中,NaCl的溶解度比I2的溶解度大 | NaCl晶体中C1—与Na+间的作用力大于碘晶体中分子间的作用力 |
C | P4O10、C6H12O6溶于水后均不导电 | P4O10、C6H12O6均属于共价化合物 |
D | 通常条件下,CH4分子比PbH4分子稳定性高 | Pb的原子半径比C的大,Pb与H之间的键能比C与H间的小 |
 pC(g)的平衡常数为K,下列对K的说法正确的是
pC(g)的平衡常数为K,下列对K的说法正确的是