题目内容
10.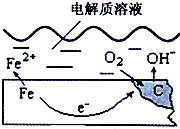 如图是钢铁在潮湿空气里发生电化学腐蚀原理示意图,发生的反应为:
如图是钢铁在潮湿空气里发生电化学腐蚀原理示意图,发生的反应为:2Fe+2H2O+O2═2Fe(OH)2,Fe(OH)2继续被氧化为Fe(OH)3,Fe(OH)3脱水生成铁锈.
请回答下列问题:
(1)在上述电化学腐蚀中,Fe作负极.
(2)正极反应式O2+2H2O+4e-=4OH-.
(3)工业上,常在钢铁设备的表面涂一层油,其作用是B(填编号).
A.防止在钢铁表面形成微小电解池 B.防止在钢铁表面形成微小原电池.
(4)含有112g铁的钢铁,理论上最多能吸收33.6L氧气(标准状况).
(5)钢铁镀铝后,表面形成的致密氧化膜能防止钢铁腐蚀,其原因是致密的氧化膜能隔绝钢材与空气中的O2、CO2和H2O等接触,使电化学腐蚀和化学腐蚀不能发生.
(6)航母舰体为钢铁,舰体在海水中发生的电化学腐蚀类型主要为吸氧腐蚀.
分析 (1)钢铁在潮湿空气里发生电化学腐蚀时,铁做负极,发生氧化反应,氧气做正极发生还原反应;
(2)在中性环境中,氧气得电子生成氢氧根离子;
(3)钢铁设备的表面涂一层油是为了隔绝空气和水;
(4)求出铁的物质的量,设反应2Fe+2H2O+O2═2Fe(OH)2中消耗的氧气的物质的量为xmol,Fe(OH)2继续被氧化为Fe(OH)3的反应中消耗的氧气的物质的量为ymol,据此计算.
(5)根据氧化铝的性质来回答;
(6)海水呈弱酸性.
解答 解:(1)上述电化学腐蚀中,铁失电子发生氧化反应,做负极,故答案为:负;
(2)在中性环境中,氧气得电子生成氢氧根离子,电极反应式为:O2+2H2O+4e-=4OH-,故答案为:O2+2H2O+4e-=4OH-;
(3)钢铁设备的表面涂一层油是为了隔绝空气和水,从而不能发生电化学腐蚀,即阻止在钢铁表面形成微小原电池,故选B;
(4)112g铁的物质的量为2mol,设反应2Fe+2H2O+O2═2Fe(OH)2中消耗的氧气的物质的量为xmol,
则有:2Fe+2H2O+O2═2Fe(OH)2
2 1
2 x
$\frac{2}{2}=\frac{1}{x}$
解得x=1mol.
Fe(OH)2继续被氧化为Fe(OH)3的反应中消耗的氧气的物质的量为ymol,则有:
4Fe(OH)2+O2+2H2O=4Fe(OH)3
4 1
2 y
故有:$\frac{4}{2}=\frac{1}{y}$
解得y=0.5mol.
故共消耗1.5mol氧气,在标况下的体积为V=nVm=1.5mol×22.4L/mol=33.6L,故答案为:33.6L;
(5)铝金属表面形成的致密氧化铝膜具有保护作用,致密的氧化膜能隔绝钢材与空气中的O2、CO2和H2O等接触,使电化学腐蚀和化学腐蚀不能发生,故答案为:致密的氧化膜能隔绝钢材与空气中的O2、CO2和H2O等接触,使电化学腐蚀和化学腐蚀不能发生.
(6)海水呈弱酸性,故航母在海水中发生吸氧腐蚀,故答案为:吸氧腐蚀.
点评 本题考查了钢铁的腐蚀和防护以及吸氧腐蚀的正负极反应和计算,难度不大,应注意的是电解质溶液的酸碱性对金属腐蚀的影响.

| A. | 把CaO放入水中:CaO═Ca2++O2- | |
| B. | 加热NaHSO4至熔化:NaHSO4═Na++H++SO42- | |
| C. | 把Al2(SO4)3放入水中:Al2(SO4)3═Al3++SO42- | |
| D. | 把NaCl放入水中:NaCl═Na++Cl- |
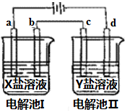 如图所示的电解池I和II中,a、b、c和d均为Pt电极.电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b<d.符合上述实验结果的盐溶液是( )
如图所示的电解池I和II中,a、b、c和d均为Pt电极.电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b<d.符合上述实验结果的盐溶液是( )| 选项 | X | Y |
| A | MgSO4 | CuSO4 |
| B | AgNO3 | KNO3 |
| C | FeSO4 | Al2(SO4)3 |
| D | CuSO4 | AgNO3 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 氯气与烧碱溶液反应:Cl2+2OH-═Cl-+ClO-+H2O | |
| B. | 在NaOH溶液中滴入几滴NH4Cl溶液:NH4++OH-═NH3•H2O | |
| C. | 将少量铜屑放入浓硝酸中:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| D. | 将稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ |
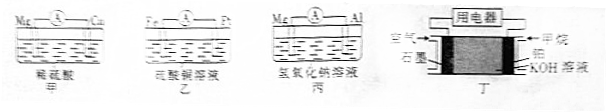
(1)根据原电池原理填写下表.
| 装置序号 | 负极 | 阳离子移向 (填电极材料名称) |
| 甲 | ||
| 乙 | . |
(3)根据上述电池分析,负极材料是否一定参加电极反应?不一定(填“是”“不是”或“不一定”).
(4)上述电池的放电过程中,丙中电解质溶液的碱性减弱(填“增强”“减弱”或“不变”,下同),丁中电解质溶液的碱性减弱.
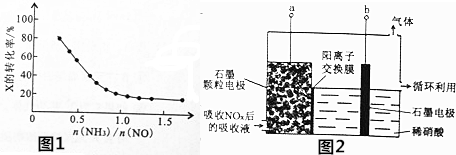
 ,下列有关叙述中正确的是
,下列有关叙述中正确的是