题目内容
16.下列说法中正确的是( )| A. | 将pH=3和pH=5的硫酸溶液等体积混合,所得溶液的pH约为3.3 | |
| B. | 1 L 0.5 mo1•L-1稀硫酸与1 L 1 mo1•L-1NaOH溶液混合反应放出57.3 kJ的热量,则表示中和热的热化学方程式为: H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(1),△H=-114.6 kJ•mo1-l | |
| C. | 已知室温时,0.1 mol•L-1某一元酸HA的电离平衡常数约为1×10-7,则该酸的电离度为0.01% | |
| D. | 已知常温下Ag2CrO4的Ksp=1.12×10-12.将等体积的2×10-4mol•L-1 AgNO3溶液和2×10-4 mol•L-1 K2CrO4溶液混合,则有Ag2CrO4沉淀产生 |
分析 A.据溶液pH计算出硫酸溶液中氢离子浓度,再计算出等体积混合后溶液中氢离子浓度及溶液的pH;
B.中和热是指生成1mol水;
C.电离平衡常数=$\frac{c({A}^{-})c({H}^{+})}{cHA)}$=1×10-7,则c(H+)=$\sqrt{1{0}^{-7}×0.1}$=10-4mol/L,电离度=$\frac{c(HA)_{电离}}{c(HA)_{总}}$×100%;
D.将等体积的2×10-4mol•L-1 AgNO3溶液和2×10-4 mol•L-1 K2CrO4溶液混合,计算c(Ag+)、c(CrO42-),结合Ksp=1.12×10-12判断是否生成沉淀.
解答 解:A.pH=3的硫酸溶液中氢离子浓度为0.001mol/L,pH=5的硫酸溶液中氢离子浓度为1×10-5mol/L,等体积混合后溶液中氢离子浓度为:$\frac{1}{2}$×(0.001mol/L+1×10-5mol/L)=5.05×10-4mol/L,溶液的pH=-lgc(H+)=-lg5.05×10-4≈3.3,故A正确;
B.中和热是指生成1mol水,热化学方程式应为$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(1),△H=-57.3kJ•mo1-l,故B错误;
C.电离平衡常数=$\frac{c({A}^{-})c({H}^{+})}{cHA)}$=1×10-7,则c(H+)=$\sqrt{1{0}^{-7}×0.1}$=10-4mol/L,电离度=$\frac{c(HA)_{电离}}{c(HA)_{总}}$×100%=$\frac{1{0}^{-4}mol/L}{0.1mol/L}×100%$=0.1%,故C错误;
D.将等体积的2×10-4mol•L-1 AgNO3溶液和2×10-4 mol•L-1 K2CrO4溶液混合,c(Ag+)=c(CrO42-)=1×10-4mol•L-1,c2(Ag+)×c(CrO42-)=1×10-12mol•L-1<1.12×10-12,则没有沉淀生成,故D错误.
故选A.
点评 本题考查了水的电离及溶液pH的简单计算,题目难度中等,试题基础性强,侧重对学生灵活运用基础知识解决实际问题的能力的培养,注意掌握溶液酸碱性的判断方法及溶液pH的计算方法.

 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案| A. | 都可以用 | B. | 只能用③ | C. | 可以用①或② | D. | 可以用③或④ |
| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 硫酸铝溶液中加入足量氨水:Al3++4OH-═AlO${\;}_{2}^{-}$+2H2O | |
| C. | FeSO4溶液与稀硝酸反应:3Fe2++NO${\;}_{3}^{-}$+4H+═3Fe3++NO↑+2H2O | |
| D. | 碳酸氢铵和足量氢氧化钠溶液反应:NH${\;}_{4}^{+}$+OH-═NH3•H2O |
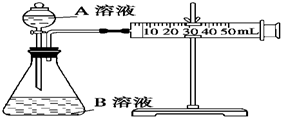 甲、乙、丙三个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):
甲、乙、丙三个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):甲组:通过测定生成CO2气体体积的方法来比较化学反应速率的大小.
实验装置如图,实验时分液漏斗中A溶液一次性放下.
A、B的成分见下表:
| 序号 | A溶液 | B溶液 |
| ① | 2mL0.1mol/LH2C2O4溶液 | 4mL 0.01mol/L KMnO4溶液 |
| ② | 2mL0.2mol/LH2C2O4溶液 | 4mL 0.01mol/L KMnO4溶液 |
结合装置,分析所给实验仪器,定量比较①②组化学反应速率大小实现该实验目的还欠缺的仪器:秒表.
乙组通过测定单位时间内KMnO4溶液浓度变化来判定反应速率快慢.所用的试剂以及条件如下表所示:
| 序号 | 溶液 | 条件 |
| ③ | 2mL 0.1mol/L H2C2O4和8mL 0.1mol/L KMnO4 | 热水 |
| ④ | 2mL 0.1mol/L H2C2O4和8mL 0.1mol/L KMnO4 | 冷水 |
②写出溶液中发生的反应的离子方程式(提示:H2C2O4为弱酸,KMnO4的还原产物为Mn2+):2MnO4-+5H2C2O4+6H+=2Mn2++l0CO2↑+8H2O.实验中该组同学始终没有看到溶液褪色,其原因是高锰酸钾过量.
丙组:丙组通过测定单位时间KMnO4溶液浓度变化来判定反应速率快慢.在25℃时,40mL 0.001mol/LKMnO4与38mL0.1mol/LH2C2O4和2mL2.38mol/LH2SO4混合液共80mL中KMnO4的浓度及对应时段的平均反应速率数据:
| 时间(min) | 0-4 | 4-8 | 8-12 | 12-16 | 16-21 | 21-22 | 22-23 |
| c(KMnO4)(10-4mol/L) | 4.58 | 4.02 | 3.36 | 2.25 | 0.72 | 0.43 | 0.23 |
| υ(KMnO4)(10-4mol/(L•min) | a | 0.14 | 0.17 | 0.28 | 0.32 | 0.29 | 0.20 |
问题讨论:已知该实验过程中溶液温度几乎不变,但是依据实验数据发现开始阶段速率却在增大.
你认为引起该反应速率增大的因素是反应过程中产生了催化剂加快了反应速率.
| 元素 | 相关信息 |
| X | X的基态原子L层电子数是K层电子数的2倍 |
| Y | Y的基态原子最外层电子排布式为:nsnnpn+2 |
| Z | Z存在质量数为23,中子数为12的核素 |
| W | W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
(2)写出W的价电子排布式3d64s2,写出Z2Y2与XY2反应的化学方程式2Na2O2+2CO2═2Na2CO3+O2,当1摩尔Z2Y2参加反应时,转移电子的数目:NA(或6.02×1023).
(3)X、Y的原子可共同形成多种分子和某种常见无机阴离子,写出其中一种分子与该无机阴离子在水溶液中反应的离子方程式:CO2+CO32-+H2O═2HCO3-.
(4)X元素的氢化物的沸点与同主族下一周期的元素的氢化物的沸点比较,沸点高的是SiH4(写化学式).
| A. | 碳酸钙与盐酸反应:CO32-+2 H+=CO2↑+H2O | |
| B. | 铁粉投入到硫酸铜溶液中:Fe+Cu2+=Fe2++Cu | |
| C. | 氯化亚铁溶液中通入氯气:2Fe2++Cl2=2Fe3++2Cl- | |
| D. | 钠和冷水反应 Na+2H2O=Na++2OH-+H2↑ |
①向久置的Na2SO3溶液中加入BaCl2溶液,再加入稀盐酸;
②向Na2CO3溶液中加入酸性CaCl2溶液;
③向Na2SO3溶液中通入Cl2,再滴加BaCl2和稀盐酸;
④向Na2SO3溶液中加入稀HNO3后再加入BaCl2溶液.
| A. | ①②④ | B. | ①②③ | C. | ①③④ | D. | ②③④ |
| A. | 分别通入酸性KMnO4溶液中 | B. | 分别点燃观察火焰 | ||
| C. | 分别通入澄清石灰水中 | D. | 分别通入溴水中 |
