题目内容
6.检验SO2中是否有CO2,应采取的措施是( )| A. | 通过澄清石灰水 | |
| B. | 通过Ba(OH)2溶液再通过石灰水 | |
| C. | 通过酸性高锰酸钾溶液再通过石灰水 | |
| D. | 通过小苏打悬浊液再通过石灰水 |
分析 二者均为酸性氧化物,二氧化硫具有还原性,则除去二氧化硫后,再利用石灰水检验二氧化碳,以此来解答.
解答 解:A.二氧化硫和二氧化碳通过石灰水都会产生白色沉淀:CO2+Ca(OH)=CaCO3↓+H2O,SO2+Ca(OH)=CaSO3↓+H2O,氢氧化钙会将气体全部吸收,不能验证有无CO2,故A错误;
B.二氧化硫和二氧化碳通过氢氧化钡都会产生白色沉淀:CO2+Ba(OH)=BaCO3↓+H2O,SO2+Ba(OH)=BaSO3↓+H2O,再通过石灰水不会出现现象,无法检验,故B错误;
C.二氧化硫和二氧化碳酸性KMnO4溶液,二氧化硫会和高锰酸钾反应而使之褪色,KMnO4酸性溶液将SO2完全吸收,再通过石灰水,二氧化碳和氢氧化钙反应会产生白色沉淀:CO2+Ca(OH)=CaCO3↓+H2O,能验证有无CO2,故C正确;
D.二氧化硫与碳酸氢钠溶液反应生成二氧化碳,无法检验原混合气体中含二氧化碳,故D错误;
故选C.
点评 本题考查物质的鉴别和检验,为高频考点,把握物质的性质、发生的反应与现象等为解答的关系,侧重分析与应用能力及二氧化硫具有还原性的考查,题目难度不大.

练习册系列答案
相关题目
12.下列常温下的下列物质属于所气态有机物的是 ( )
| A. | CH3Cl | B. | CH2Cl2 | C. | CCl4 | D. | 苯 |
17.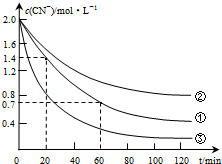 生产中可用双氧水氧化法处理电镀含氰废水,某化学兴趣小组模拟该法探究有关因素对破氰反应速率的影响(注:破氰反应是指氧化剂将CN-氧化的反应).
生产中可用双氧水氧化法处理电镀含氰废水,某化学兴趣小组模拟该法探究有关因素对破氰反应速率的影响(注:破氰反应是指氧化剂将CN-氧化的反应).
【相关资料】
①氰化物主要是以CN-和[Fe(CN)6]3-两种形式存在.
②Cu2+可作为双氧水氧化法破氰处理过程中的催化剂;Cu2+在偏碱性条件下对双氧水分解影响较弱,可以忽略不计.
③[Fe(CN)6]3-较CN-难被双氧水氧化,且pH越大,[Fe(CN)6]3-越稳定,越难被氧化.
【实验过程】
在常温下,控制含氰废水样品中总氰的初始浓度和催化剂Cu2+的浓度相同,调节含氰废水样品不同的初始pH和一定浓度双氧水溶液的用量,设计如下对比实验:
(l)请完成以下实验设计表(表中不要留空格)
实验测得含氰废水中的总氰浓度(以CN-表示)随时间变化关系如图所示.
(2)实验①中20~60min时间段反应速率:υ(CN-)=0.0175mol•L-1•min-1.
(3)实验①和实验②结果表明,含氰废水的初始pH增大,破氰反应速率减小,其原因可能是初始pH增大,催化剂Cu2+会形成Cu(OH)2沉淀,影响了Cu2+的催化作用(或初始pH增大,[Fe(CN)6]3-较中性和酸性条件下更稳定,难以氧化)(填一点即可).在偏碱性条件下,含氰废水中的CN-最终被双氧水氧化为HCO3-,同时放出NH3,试写出该反应的离子方程式:CN-+H2O2+H2O═NH3↑+HCO3-.
(4)该兴趣小组同学要探究Cu2+是否对双氧水氧化法破氰反应起催化作用,请你帮助他设计实验并验证上述结论,完成下表中内容.(己知:废水中的CN-浓度可用离子色谱仪测定)
 生产中可用双氧水氧化法处理电镀含氰废水,某化学兴趣小组模拟该法探究有关因素对破氰反应速率的影响(注:破氰反应是指氧化剂将CN-氧化的反应).
生产中可用双氧水氧化法处理电镀含氰废水,某化学兴趣小组模拟该法探究有关因素对破氰反应速率的影响(注:破氰反应是指氧化剂将CN-氧化的反应).【相关资料】
①氰化物主要是以CN-和[Fe(CN)6]3-两种形式存在.
②Cu2+可作为双氧水氧化法破氰处理过程中的催化剂;Cu2+在偏碱性条件下对双氧水分解影响较弱,可以忽略不计.
③[Fe(CN)6]3-较CN-难被双氧水氧化,且pH越大,[Fe(CN)6]3-越稳定,越难被氧化.
【实验过程】
在常温下,控制含氰废水样品中总氰的初始浓度和催化剂Cu2+的浓度相同,调节含氰废水样品不同的初始pH和一定浓度双氧水溶液的用量,设计如下对比实验:
(l)请完成以下实验设计表(表中不要留空格)
| 实验 序号 | 实验目的 | 初始pH | 废水样品体积/mL | CuSO4溶液的体积/mL | 双氧水溶液的体积/mL | 蒸馏水的体积/mL |
| ① | 为以下实验操作参考 | 7 | 60 | 10 | 10 | 20 |
| ② | 废水的初始pH对破氰反应速率的影响 | 12 | 60 | 10 | 10 | 20 |
| ③ | 双氧水的浓度对破氰反应速率的影响 | 7 | 60 | 10 | 20 | 10 |
(2)实验①中20~60min时间段反应速率:υ(CN-)=0.0175mol•L-1•min-1.
(3)实验①和实验②结果表明,含氰废水的初始pH增大,破氰反应速率减小,其原因可能是初始pH增大,催化剂Cu2+会形成Cu(OH)2沉淀,影响了Cu2+的催化作用(或初始pH增大,[Fe(CN)6]3-较中性和酸性条件下更稳定,难以氧化)(填一点即可).在偏碱性条件下,含氰废水中的CN-最终被双氧水氧化为HCO3-,同时放出NH3,试写出该反应的离子方程式:CN-+H2O2+H2O═NH3↑+HCO3-.
(4)该兴趣小组同学要探究Cu2+是否对双氧水氧化法破氰反应起催化作用,请你帮助他设计实验并验证上述结论,完成下表中内容.(己知:废水中的CN-浓度可用离子色谱仪测定)
| 实验步骤(不要写出具体操作过程) | 预期实验现象和结论 |
| 分别取等体积、等浓度的含氰废水于甲、乙两支试管中,再分别加入等体积、等浓度的双氧水溶液,只向甲试管中加入少量的无水硫酸铜粉末,用离子色谱仪测定相同反应时间内两支试管中的CN-浓度 | 相同时间内,若甲试管中的CN-浓度小于乙试管中的CN-浓度,则Cu2+对双氧水破氰反应起催化作用;若两试管中的CN-浓度相同,则Cu2+对双氧水破氰反应不起催化作用 |
14.下列物质完全燃烧,生成的CO 2的物质的量与消耗O 2的物质的量相等的是( )
| A. | CH 4 | B. | C 2H 4 | C. | C 2H 6O | D. | C 6H 12O 6 |
1.将 转变为
转变为 的方法为( )
的方法为( )
 转变为
转变为 的方法为( )
的方法为( )| A. | 与足量的NaOH溶液共热后,再通入CO2 | |
| B. | 与氢氧化钠溶液热,通入足量的HCl | |
| C. | 与稀H2SO4共热后,加入足量的Na2CO3 | |
| D. | 与稀H2SO4共热后,加入足量的NaOH |
18.下列化学用语正确的是( )
| A. | 聚丙烯的结构简式: | B. | 丙烷分子的比例模型: | ||
| C. | 羟基的电子式: | D. | 乙烯的结构简式:CH2=CH2 |
15.下列结论均出自《实验化学》中的实验,其中错误的是( )
| A. | 往新配制的可溶性淀粉溶液中滴加碘水,溶液显蓝色,用CCl4不能从中萃取出碘 | |
| B. | 将3~4个火柴头浸于水中,片刻后取少量溶液于试管中,加AgNO3溶液、稀硝酸和NaNO2溶液,若出现白色沉淀,说明含有氯元素 | |
| C. | 硝酸钾饱和溶液冷却未出现结晶时,可以用玻棒充分磨擦器皿壁促使晶体析出 | |
| D. | 提取海带中碘元素时,为保证I-完全氧化为I2,加入的氧化剂(H2O2或新制氯水)均应过量 |