题目内容
15.下列结论均出自《实验化学》中的实验,其中错误的是( )| A. | 往新配制的可溶性淀粉溶液中滴加碘水,溶液显蓝色,用CCl4不能从中萃取出碘 | |
| B. | 将3~4个火柴头浸于水中,片刻后取少量溶液于试管中,加AgNO3溶液、稀硝酸和NaNO2溶液,若出现白色沉淀,说明含有氯元素 | |
| C. | 硝酸钾饱和溶液冷却未出现结晶时,可以用玻棒充分磨擦器皿壁促使晶体析出 | |
| D. | 提取海带中碘元素时,为保证I-完全氧化为I2,加入的氧化剂(H2O2或新制氯水)均应过量 |
分析 A.碘与淀粉发生反应,溶液中没有碘单质;
B.NaNO2的作用是将火柴头中的ClO3-还原成Cl-;
C.用玻璃棒摩擦是为了产生适量的晶核;
D.过量氯水可把碘单质氧化成碘酸根离子.
解答 解:A.碘与淀粉形成的是络合物,溶液没有碘单质,故不能被萃取,故A正确;
B.NaNO2的作用是将火柴头中的ClO3-还原成Cl-,加AgNO3溶液、稀硝酸生成白色沉淀可检验火柴头中的氯元素,故B正确;
C.太过干净的容器使得溶液里面没有晶核,因此很难析出晶体,用玻璃棒摩擦是为了产生适量的晶核,从而析出晶体,故C正确;
D.海带中碘元素提取时氧化滤液中的I-时应加入适量氯水,否则氯水可把碘单质氧化成碘酸根离子,故D错误.
故选D.
点评 本题考查较为综合,涉及物质的分离提纯、检验等知识,侧重于考查学生化学实验的评价能力,为高考常见题型,注意把握相关物质的性质,题目难度不大.

练习册系列答案
相关题目
5. 某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭 真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
NH2COONH4(s)?2NH3(g)+CO2(g)
实验测得的不同温度下的平衡数据列于下表:
①可以判断该分解反应已经达到平衡的是BC.
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算 25.0℃时氨基甲酸铵的分解平衡常数:K=c2(NH3)•c(CO2)=($\frac{2}{3}$c总)2($\frac{1}{3}$c总)=$\frac{4}{27}$×(4.8×10-3)3=1.6×10-8.
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在 25.0℃下达到分解平衡.若在恒温下压缩容器体积,氨基甲酸铵固体的质量增加(填“增加”、“减少”或“不变”).
④氨基甲酸铵分解反应的焓变△H>0(填“>”、“=”或“<”),熵变△S>0(填“>”、“=”或“<”).
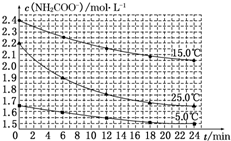
(2)已知:NH2COONH4+2H2O?NH4HCO3+NH3•H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定其水解反应速率,得到c(NH2COO-)随时间的变化趋势如图所示.
⑤计算 25.0℃时,0~6min 氨基甲酸铵水解反应的平均速率:0.05mol•L-1•min-1.
⑥根据图中信息,如何说明该水解反应速率随温度升高而增大:25.0℃时反应物的起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比15.0℃时的大.
 某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭 真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
NH2COONH4(s)?2NH3(g)+CO2(g)
实验测得的不同温度下的平衡数据列于下表:
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度/mol•L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算 25.0℃时氨基甲酸铵的分解平衡常数:K=c2(NH3)•c(CO2)=($\frac{2}{3}$c总)2($\frac{1}{3}$c总)=$\frac{4}{27}$×(4.8×10-3)3=1.6×10-8.
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在 25.0℃下达到分解平衡.若在恒温下压缩容器体积,氨基甲酸铵固体的质量增加(填“增加”、“减少”或“不变”).
④氨基甲酸铵分解反应的焓变△H>0(填“>”、“=”或“<”),熵变△S>0(填“>”、“=”或“<”).
(2)已知:NH2COONH4+2H2O?NH4HCO3+NH3•H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定其水解反应速率,得到c(NH2COO-)随时间的变化趋势如图所示.
⑤计算 25.0℃时,0~6min 氨基甲酸铵水解反应的平均速率:0.05mol•L-1•min-1.
⑥根据图中信息,如何说明该水解反应速率随温度升高而增大:25.0℃时反应物的起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比15.0℃时的大.
6.检验SO2中是否有CO2,应采取的措施是( )
| A. | 通过澄清石灰水 | |
| B. | 通过Ba(OH)2溶液再通过石灰水 | |
| C. | 通过酸性高锰酸钾溶液再通过石灰水 | |
| D. | 通过小苏打悬浊液再通过石灰水 |
10.欲除去下列物质中混入的少量杂质(括号内物质为杂质),不能达到目的是( )
| A. | 乙酸乙酯(乙酸):加饱和Na2CO3溶液,充分振荡静置后,分液 | |
| B. | 乙醇(水):加入新制生石灰,蒸馏 | |
| C. | 溴苯(溴):加入NaOH溶液,充分振荡静置后,分液 | |
| D. | 苯(苯酚):加浓溴水,静置后,过滤 |
7.下列说法正确的是( )
| A. | 乙烯的电子式为: | B. | 乙烯的球棍模型为 | ||
| C. | 乙烯分子是空间平面结构 | D. | 乙烯的结构简式为CH2CH2 |
5.下列物质的电子式正确的是( )
| A. | NaCl  | B. | HCl  | C. | MgBr2  | D. | NaOH  |
 的名称是2,4-二甲基己烷
的名称是2,4-二甲基己烷 的名称是2-甲基-2-戊烯
的名称是2-甲基-2-戊烯