题目内容
14.下列物质完全燃烧,生成的CO 2的物质的量与消耗O 2的物质的量相等的是( )| A. | CH 4 | B. | C 2H 4 | C. | C 2H 6O | D. | C 6H 12O 6 |
分析 有机物完全燃烧消耗的氧气的多少不但与C、H原子数的多少有关,还与分子中氧原子数目有关,并且当有机物分子组成为Cn(H2O)m时,耗O2的物质的量与生成的CO2的物质的量相等,设有机物通式为CxHy,则1mol有机物完全燃烧,耗氧量为(x+$\frac{y}{4}$-$\frac{z}{2}$)mol,据此计算判断..
解答 解:A.1molCH 4完全燃烧,生成1molCO2,耗氧量=(1+$\frac{4}{4}$)mol=2mol,故A错误;
B.1molC 2H 4完全燃烧,生成2molCO2,耗氧量=(2+$\frac{4}{4}$)mol=3mol,故B错误;
C.1molC 2H 6O完全燃烧,生成2molCO2,耗氧量=(2+$\frac{6}{4}$-$\frac{1}{2}$)mol=3mol,故C错误;
D.1molC 6H 12O 6完全燃烧,生成6molCO2,耗氧量=(6+$\frac{12}{4}$-$\frac{6}{2}$)mol=6mol,故D正确.
故选D.
点评 本题考查有机物燃烧耗氧量问题,题目难度不大,注意根据烃的燃烧通式解答.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
20.下列反应属于吸热反应的是( )
| A. | 碳酸钙受热分解 | B. | 乙醇燃烧 | C. | 炸药爆炸 | D. | 氧化钙溶于水 |
5.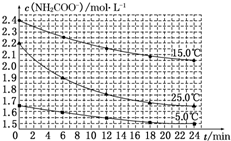 某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭 真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
NH2COONH4(s)?2NH3(g)+CO2(g)
实验测得的不同温度下的平衡数据列于下表:
①可以判断该分解反应已经达到平衡的是BC.
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算 25.0℃时氨基甲酸铵的分解平衡常数:K=c2(NH3)•c(CO2)=($\frac{2}{3}$c总)2($\frac{1}{3}$c总)=$\frac{4}{27}$×(4.8×10-3)3=1.6×10-8.
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在 25.0℃下达到分解平衡.若在恒温下压缩容器体积,氨基甲酸铵固体的质量增加(填“增加”、“减少”或“不变”).
④氨基甲酸铵分解反应的焓变△H>0(填“>”、“=”或“<”),熵变△S>0(填“>”、“=”或“<”).
(2)已知:NH2COONH4+2H2O?NH4HCO3+NH3•H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定其水解反应速率,得到c(NH2COO-)随时间的变化趋势如图所示.
⑤计算 25.0℃时,0~6min 氨基甲酸铵水解反应的平均速率:0.05mol•L-1•min-1.
⑥根据图中信息,如何说明该水解反应速率随温度升高而增大:25.0℃时反应物的起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比15.0℃时的大.
 某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭 真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
NH2COONH4(s)?2NH3(g)+CO2(g)
实验测得的不同温度下的平衡数据列于下表:
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度/mol•L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算 25.0℃时氨基甲酸铵的分解平衡常数:K=c2(NH3)•c(CO2)=($\frac{2}{3}$c总)2($\frac{1}{3}$c总)=$\frac{4}{27}$×(4.8×10-3)3=1.6×10-8.
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在 25.0℃下达到分解平衡.若在恒温下压缩容器体积,氨基甲酸铵固体的质量增加(填“增加”、“减少”或“不变”).
④氨基甲酸铵分解反应的焓变△H>0(填“>”、“=”或“<”),熵变△S>0(填“>”、“=”或“<”).
(2)已知:NH2COONH4+2H2O?NH4HCO3+NH3•H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定其水解反应速率,得到c(NH2COO-)随时间的变化趋势如图所示.
⑤计算 25.0℃时,0~6min 氨基甲酸铵水解反应的平均速率:0.05mol•L-1•min-1.
⑥根据图中信息,如何说明该水解反应速率随温度升高而增大:25.0℃时反应物的起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比15.0℃时的大.
6.检验SO2中是否有CO2,应采取的措施是( )
| A. | 通过澄清石灰水 | |
| B. | 通过Ba(OH)2溶液再通过石灰水 | |
| C. | 通过酸性高锰酸钾溶液再通过石灰水 | |
| D. | 通过小苏打悬浊液再通过石灰水 |

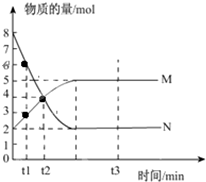 一定温度下,在容积为V L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:
一定温度下,在容积为V L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示: 的名称是2,4-二甲基己烷
的名称是2,4-二甲基己烷 的名称是2-甲基-2-戊烯
的名称是2-甲基-2-戊烯