题目内容
11.在方框内填上相应数字配平下列离子方程式,并把所缺的物质补齐.□C2O42-+□Mn04-+□16H+=□CO2↑+□Mn2++□8H20.
分析 反应中草酸根中+3价碳化合价升高为二氧化碳中+4价,高锰酸根离子中+7价锰化合价降为+2价锰离子,依据氧化还原反应得失电子守恒、原子个数守恒配平方程式.
解答 解:反应中草酸根中+3价碳化合价升高为二氧化碳中+4价,高锰酸根离子中+7价锰化合价降为+2价锰离子,要使氧化剂得到电子数等于还原剂失去电子数,则高锰酸根离子系数为2,草酸根离子系数为5,依据原子个数守恒,方程式为:2MnO4-+5C2O42-+16H+=2 Mn2++10CO2↑+8H20;
故答案为:5;2;16H+;10;2;8H20.
点评 本题考查氧化还原反应,为高频考点,题目难度中等,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念的考查,注意从元素化合价角度分析.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
17.已知同温同浓度时,①H2CO3比H2S的电离(一级电离)常数大,②H2S比HCO3-的电离常数大(即H2S的K1比H2CO3的K2大),根据酸与盐的反应规律,下列反应中不正确的是( )
| A. | Na2CO3+H2S=NaHCO3+NaHS | B. | Na2S+H2O+CO2=NaHS+NaHCO3 | ||
| C. | 2NaHCO3+H2S=Na2S+2H2O+2CO2 | D. | NaHS+H20+CO2=NaHCO3+H2S |
6.检验SO2中是否有CO2,应采取的措施是( )
| A. | 通过澄清石灰水 | |
| B. | 通过Ba(OH)2溶液再通过石灰水 | |
| C. | 通过酸性高锰酸钾溶液再通过石灰水 | |
| D. | 通过小苏打悬浊液再通过石灰水 |
1.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 9g甲基(-CH3)所含有的电子数是10 NA个 | |
| B. | 22.4L乙烷中含有的共价键数为7NA个 | |
| C. | 4.2g C3H6中含有的碳碳双键数一定为0.1NA | |
| D. | 常温下,14g乙烯和丙烯的混合物中总原子数为3NA个 |

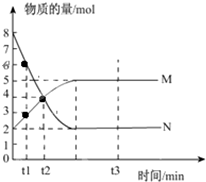 一定温度下,在容积为V L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:
一定温度下,在容积为V L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:
 的名称是2,4-二甲基己烷
的名称是2,4-二甲基己烷 的名称是2-甲基-2-戊烯
的名称是2-甲基-2-戊烯