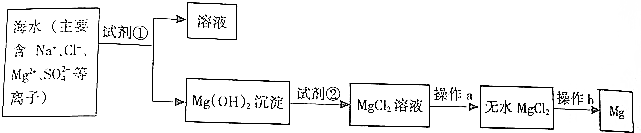
题目内容
13.火药是中国古代四大发明之一,由硫磺、火硝和木炭粉均匀混合而成,点燃后可能发生的反应:S+2KNO3+3C═N2↑+3CO2↑+X(已配平),则物质X是( )| A. | K2S | B. | SO2 | C. | H2S | D. | SO3 |
分析 S+2KNO3+3C═N2↑+3CO2↑+X(已配平)中,遵循原子守恒,结合原子守恒判断X的化学式,以此来解答.
解答 解:S+2KNO3+3C═N2↑+3CO2↑+X(已配平)中,由原子守恒可知X中含2个K原子、1个S原子,则X的化学式为K2S,
故选A.
点评 本题考查氧化还原反应,为高频考点,把握质量守恒定律为解答的关键,侧重分析与应用能力的考查,注意守恒法应用,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3. 某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管后立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线稍下,并记下读数;
④量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数.请回答:
(1)以上操作步骤中有一步有错误,请指出编号①,该错误操作会导致测定结果偏大(填“偏大”、“偏小”或“无影响”)
(2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入乙中.(从图中选填“甲”或“乙”)
(3)下列操作会引起实验结果偏大的是:BC(填编号)
A.在锥形瓶装液前,留有少量蒸馏水
B.滴定前,碱式滴定管尖嘴有气泡,滴定后无气泡
C.锥形瓶先用蒸馏水洗涤后,再用待测液润洗
D.用酸式滴定管量取待测液时将一滴待测液滴在锥形瓶外
(4)判断到达滴定终点的现象是:锥形瓶中溶液从无 色变为浅红色,且半分钟之内不再改变.
(5)以下是实验数据记录表:
通过计算可得,该盐酸浓度为:0.16mol•L-1(计算结果保留2位小数).
 某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:①用蒸馏水洗涤碱式滴定管后立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线稍下,并记下读数;
④量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数.请回答:
(1)以上操作步骤中有一步有错误,请指出编号①,该错误操作会导致测定结果偏大(填“偏大”、“偏小”或“无影响”)
(2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入乙中.(从图中选填“甲”或“乙”)
(3)下列操作会引起实验结果偏大的是:BC(填编号)
A.在锥形瓶装液前,留有少量蒸馏水
B.滴定前,碱式滴定管尖嘴有气泡,滴定后无气泡
C.锥形瓶先用蒸馏水洗涤后,再用待测液润洗
D.用酸式滴定管量取待测液时将一滴待测液滴在锥形瓶外
(4)判断到达滴定终点的现象是:锥形瓶中溶液从无 色变为浅红色,且半分钟之内不再改变.
(5)以下是实验数据记录表:
| 滴定次数 | 盐酸体积(ml) | NaOH溶液体积读数(ml) | |
| 滴定前 | 滴定后 | ||
| 20.00 | 0.00 | 16.30 | |
| 2 | 20.00 | 0.00 | 16.22 |
4.下列有关说法正确的是( )
| A. | 某温度下,1L pH=8的纯水中含OH-为10 -6mol | |
| B. | 电解精炼铜过程中,阳极质量的减少值与阴极质量的增加值一定相等 | |
| C. | 合成氨的反应是放热反应,则采用低温条件可以提高氨的生成速率 | |
| D. | CH3COOH溶液加水稀释后,溶液中$\frac{c(C{H}_{3}COOH)}{c(O{H}^{-})}$的值减小 |
1.为确定某溶液由以下离子Na+、Mg2+、Ba2+、SO42-、I-、CO32-中的哪几种微粒组成.进行以下实验,分别取样:①用pH计测试,溶液显弱酸性;②加氯水和淀粉无明显现象.为确定该溶液的组成,还需检验的离子是( )
| A. | Na+ | B. | SO42- | C. | Ba2+ | D. | Mg2+ |
8.碳有三种同位素:${\;}_{6}^{12}$C、${\;}_{6}^{13}$C和${\;}_{6}^{14}$C,它们之间不同的是( )
| A. | 电子数 | B. | 中子数 | C. | 质子数 | D. | 原子序数 |
18.常温下,下列物质与水混合后静置,出现分层的是( )
| A. | 苯 | B. | 乙醇 | C. | 乙酸 | D. | 氯化氢 |
5.黄酒在存放过程中,有部分乙醇转化为乙酸,导致黄酒变酸.该过程中发生的反应为( )
| A. | 取代反应 | B. | 氧化反应 | C. | 加成反应 | D. | 酯化反应 |
17.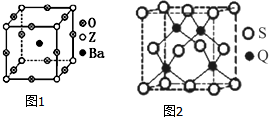 已知X、Y、Z、R、Q为周期表中原子序数依次增大的前36号元素.相关信息如下:
已知X、Y、Z、R、Q为周期表中原子序数依次增大的前36号元素.相关信息如下:
请回答下列问题:
(1)YX3中心原子的杂化轨道类型是sp3,离子化合物YX5的电子式是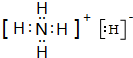 .
.
(2)CO与Y2属于等电子体,1 个CO分子中含有的π键数目是2个.
(3)工业上利用ZO2和碳酸钡在熔融状态下制取化合物A(A可看做一种含氧酸盐).A晶体的晶胞为正方体(如图1).
①制备A的化学反应方程式是TiO2+BaCO3═BaTiO3+CO2↑;
②在A晶体中,Z的配位数为6;
③在A晶体中,若将Z元素置于立方体的体心,Ba元素置于立方体的顶点,则O元素处于立方体的面心.
(4)R2+离子的外围电子层电子排布式为3d9.R2O的熔点比R2S的高(填“高”或“低”).
(5)Q元素和硫(S)元素能够形成化合物B.B晶体的晶胞为正方体(如图2),若晶胞棱长为540.0pm,则晶胞密度为$\frac{4×\frac{(65+32)g/mol}{6.02×1{0}^{23}mo{l}^{-1}}}{(540×1{0}^{-10}cm)^{3}}$=4.1g•cm-3(列式并计算).
 已知X、Y、Z、R、Q为周期表中原子序数依次增大的前36号元素.相关信息如下:
已知X、Y、Z、R、Q为周期表中原子序数依次增大的前36号元素.相关信息如下:| X元素是宇宙中最丰富的元素 |
| Y元素基态原子的核外p电子数比s电子数少1 |
| Z元素被誉为“太空金属”,也有“生物金属”之称,其基态原子次外层有2个未成对电子 |
| R元素在元素周期表的第十一列 |
| Q元素在周期表里与R元素在同一个分区 |
(1)YX3中心原子的杂化轨道类型是sp3,离子化合物YX5的电子式是
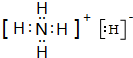 .
.(2)CO与Y2属于等电子体,1 个CO分子中含有的π键数目是2个.
(3)工业上利用ZO2和碳酸钡在熔融状态下制取化合物A(A可看做一种含氧酸盐).A晶体的晶胞为正方体(如图1).
①制备A的化学反应方程式是TiO2+BaCO3═BaTiO3+CO2↑;
②在A晶体中,Z的配位数为6;
③在A晶体中,若将Z元素置于立方体的体心,Ba元素置于立方体的顶点,则O元素处于立方体的面心.
(4)R2+离子的外围电子层电子排布式为3d9.R2O的熔点比R2S的高(填“高”或“低”).
(5)Q元素和硫(S)元素能够形成化合物B.B晶体的晶胞为正方体(如图2),若晶胞棱长为540.0pm,则晶胞密度为$\frac{4×\frac{(65+32)g/mol}{6.02×1{0}^{23}mo{l}^{-1}}}{(540×1{0}^{-10}cm)^{3}}$=4.1g•cm-3(列式并计算).