题目内容
1.下列说法正确的是( )| A. |  图中△H1=△H2+△H3 | |
| B. |  如图在催化剂条件下,反应的活化能等于E1+E2 | |
| C. |  如图表示醋酸溶液滴定 NaOH 和氨水混合溶液的电导率变化曲线 | |
| D. |  如图可表示由CO(g)生成CO2(g)的过程中要放出566kJ 热量 |
分析 A、根据盖斯定律来分析;
B、催化剂改变了反应历程,E1、E2分别代表各步反应的活化能;
C、醋酸和一水合氨是弱电解质,在溶液里部分电离,氢氧化钠是强电解质,完全电离,向混合溶液中滴加醋酸,醋酸先和氢氧化钠反应生成强电解质醋酸钠,氢氧化钠完全反应后,醋酸再和氨水反应生成强电解质醋酸铵,根据溶液中离子浓度变化与电导率的关系分析解答;
D、未指明是几摩尔CO燃烧放出566KJ的热量.
解答 解:A、根据盖斯定律来可知:一个反应无论是一步完成还是分为数步完成,其热效应是相同的,故应有:△H1=-△H2-△H3,故A错误;
B、E1、E2分别代表反应过程中各步反应的活化能,整个反应的活化能为能量较高的E1,故B错误;
C、氢氧化钠是强电解质,一水合氨是弱电解质,滴加的弱电解质先和氢氧化钠反应生成强电解质醋酸钠,但溶液体积不断增大,溶液被稀释,所以电导率下降;当氢氧化钠完全被中和后,醋酸继续与弱电解质反应生成强电解质醋酸铵,所以电导率增大;氨水也完全反应后,继续滴加醋酸,因为溶液被稀释,电导率有下降趋势,故C正确;
D、图象中未标明CO、氧气以及CO2的物质的量与焓变的值的数值计量关系,故D错误;
故选C.
点评 本题考查了盖斯定律的应用,活化能概念应用,反应焓变的意义以及溶液的导电性等问题,难度不大.

 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案下列离子能大量共存,且满足相应要求的是
选项 | 离子 | 要求 |
A | K+、Cl-、SO42-、MnO4- | c(K+)< c(Cl-) |
B | Na+、Ca2+、I-、NO3- | c(H+)/c(OH-)=1×1014 |
C[ | Al3+、NH4+、SO42-、CH3COO- | 滴加NaOH溶液立刻有气体产生 |
D | Na+、Mg2+、Ag+、NO3- | 滴加氨水先有沉淀产生,后沉淀部分溶解 |
下面一些报道中,你认为科学的是( )
A.疏通煤气管道时,充入氩气引起爆炸
B.新粉刷过石灰浆的墙壁释放出CO2使一老汉窒息而死
C.有易燃易爆物的工作场所,严禁穿化纤衣服
D.本饮料纯天然,绝对不含化学物质
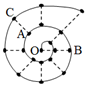 某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )| A. | 原子半径大小顺序:r(B)>r(C)>r(A) | |
| B. | B、C最高价氧化物的水化物可以相互反应 | |
| C. | 虚线相连的元素处于同一族,A、C元素都位于元素周期表ⅥA族 | |
| D. | A分别与B、C形成的化合物中化学键类型相同 |
| A. | a<c+d | B. | A的转化率增大 | ||
| C. | D的体积分数变大 | D. | 平衡向正反应方向移动 |
| A. | 溶液和胶体的本质区别为是否能产生丁达尔效应 | |
| B. | K2Cr2O7溶液和氢溴酸能存放于同一药品橱内 | |
| C. | 用带玻璃塞的细口试剂瓶保存氢氟酸 | |
| D. | CH4和C2H4均属于常用危险品中的易燃气体 |