题目内容
16.硫、氮的化合物在某些领域中扮演着重要的角色.(1)SO2是形成硫酸型酸雨的主要原因,酸雨的pH<5.6 (填“>”或“<”),某同学收集当地的酸雨进行pH的测量,刚开始测得雨水的pH=5.2,过一段时间再测量雨水pH=4.7,请用所学化学知识解释雨水pH值减少的原因:雨水中的亚硫酸被氧气氧化成硫酸,酸性增强;
(2)硝酸是工业三大强酸之一,试从原料的利用率和环境保护两个角度分析,溶解等量的金属铜用浓硝酸好,还是稀硝酸好?根据化学方程式作简要分析:溶解等质量的铜,使用稀硝酸时消耗的硝酸少,且产生的有害气体也少,故用稀硝酸好;
(3)氮的化合物在航天航空事业中起着不可替代的作用.神舟七号飞船的外壳是一种新型结构陶瓷材料,它的主要成分是氮化硅.工业上使用SiCl4、N2和H2在一定条件下反应生成氮化硅,写出该反应的化学方程式(不必配平):SiCl4+N2+H2→Si3N4+HCl.
分析 (1)正常的雨中因为溶有二氧化碳,其pH=5.6,二氧化硫形成的酸雨中含有亚硫酸,易被空气中氧气氧化成硫酸;
(2)根据铜与稀硝酸及浓硝酸反应的方程式可知,溶解等质量的铜,使用稀硝酸时消耗的硝酸少,且产生的有害气体也少;
(3)用SiCl4、N2和H2在一定条件下反应生成氮化硅,根据元素守恒可知,还有生成HCl,据此书写化学方程式.
解答 解:(1)正常的雨中因为溶有二氧化碳,其pH=5.6,所以硫酸型酸雨的pH<5.6,二氧化硫形成的酸雨中含有亚硫酸,易被空气中氧气氧化成硫酸,溶液的酸性增强,
故答案为:<;雨水中的亚硫酸被氧气氧化成硫酸,酸性增强;
(2)铜与稀硝酸及浓硝酸反应的方程式为Cu+4HNO3(浓)═Cu(NO3)+2NO2↑+2H2O,3Cu+8HNO3(浓)═3Cu(NO3)+2NO↑+4H2O,根据方程式可知,溶解等质量的铜,使用稀硝酸时消耗的硝酸少,且产生的有害气体也少,故用稀硝酸好,
故答案为:溶解等质量的铜,使用稀硝酸时消耗的硝酸少,且产生的有害气体也少,故用稀硝酸好;
(3)用SiCl4、N2和H2在一定条件下反应生成氮化硅,根据元素守恒可知,还有生成HCl,反应的化学方程式为SiCl4+N2+H2→Si3N4+HCl,
故答案为:SiCl4+N2+H2→Si3N4+HCl.
点评 本题考查与生活和实际相关的反应的方程式的书写,涉及氧化还原反应,题目难度不大,把握氧化还原反应原理为解答的关键,侧重于考查学生的分析能力和对基础知识的应用能力.

练习册系列答案
相关题目
5.下列关于化学平衡常数的说法中,正确的是( )
| A. | 在任何条件下,化学平衡常数都是一个定值 | |
| B. | 化学平衡常数K可以推断一个可逆反应进行的程度 | |
| C. | 化学平衡常数K只与温度、反应物浓度、体系的压强有关 | |
| D. | 当改变反应物的浓度时,化学平衡常数会发生改变 |
11.在反应A+B(s)═C中,若增大压强或降低温度,B的转化率均增大,则反应体系应是( )
| A. | A是固体,C是气体,正反应吸热 | B. | A是气体,C是气体,正反应放热 | ||
| C. | A是气体,C是固体,正反应放热 | D. | A是气体,C是气体,正反应吸热 |
6.下列有关KNO3叙述正确的是( )
| A. | 钾离子结构示意图: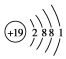 | |
| B. | KNO3溶液中,H+、Na+、Br-、I-能大量共存 | |
| C. | 可用于生产复合肥、配制炸药和制造瓷釉彩药 | |
| D. | KNO3溶液中混有少量NaCl时,可用重结晶的方法提纯,原因是KNO3溶解度大 |
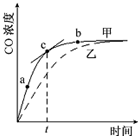 氮化铝(AlN)是一种人工合成的非氧化物陶瓷材料,可在温度高于1500℃时,通过碳热还原法制得.实验研究认为,该碳热还原反应分两步进行:
氮化铝(AlN)是一种人工合成的非氧化物陶瓷材料,可在温度高于1500℃时,通过碳热还原法制得.实验研究认为,该碳热还原反应分两步进行: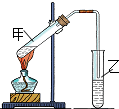 (1)“酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置由乙醇、乙酸和浓硫酸来制取乙酸乙酯.回答下列问题:
(1)“酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置由乙醇、乙酸和浓硫酸来制取乙酸乙酯.回答下列问题: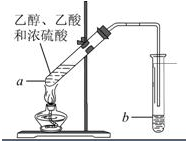 红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯.在实验室也可以用如图所示的装置制取乙酸乙酯,请回答下列问题.
红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯.在实验室也可以用如图所示的装置制取乙酸乙酯,请回答下列问题.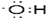
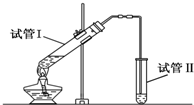 实验室用如图所示装置制备少量乙酸乙 酯.
实验室用如图所示装置制备少量乙酸乙 酯.