题目内容
甲同学想通过如图所示装置(夹持装置已略去)进行实验,研究推断SO2与Na2O2反应的产物.

回答下列问题:
(1)装置B的作用 .装置D的作用 .
(2)如何检验反应中是否有O2生成 .
(3)假如Na2O2已反应完全,为确定C中固体产物的成分,甲设计如下实验:
得出结论:产物是Na2SO4.
该方案是否合理 (填是或否),理由是 .
(4)若上述方案不合理,请设计一个能确定产物成分的实验方案,填写下表(可不填满).

回答下列问题:
(1)装置B的作用
(2)如何检验反应中是否有O2生成
(3)假如Na2O2已反应完全,为确定C中固体产物的成分,甲设计如下实验:

得出结论:产物是Na2SO4.
该方案是否合理
(4)若上述方案不合理,请设计一个能确定产物成分的实验方案,填写下表(可不填满).
| 操作步骤(加入试剂) | 实验现象 | 结论 |
| 1 | ||
| 2 | ||
| 3 | ||
| 4 |
考点:性质实验方案的设计,物质检验实验方案的设计
专题:
分析:A用于制备二氧化硫气体,B干燥装置,除去二氧化硫中的水蒸气,防止水与过氧化钠反应而影响实验结论,D可用于吸收二氧化硫,防止污染空气,并吸收空气中的水和二氧化碳,防止与过氧化钠反应,如能生成氧气,可用带有余烬的木条检验,假如Na2O2已反应完全,为确定C中固体产物的成分是否为Na2SO4,应加入盐酸和氯化钡检验,注意不能用硝酸,防止亚硫酸钠被硝酸氧化,以此解答该题.
解答:
解:(1)因生成的二氧化硫混有水蒸气,为防止较多的水蒸气与过氧化钠反应,应先用浓硫酸干燥,二氧化硫有毒,不能直接排空,二氧化硫是酸性氧化物能和碱性物质反应,所以用碱石灰吸收二氧化硫防止污染空气,且D可吸收空气中的水和二氧化碳,防止与过氧化钠反应,
故答案为:干燥二氧化硫,防止较多的水蒸气与过氧化钠反应;防止空气中的水和二氧化碳进入C装置与过氧化钠反应,同时吸收过量的二氧化硫,以免污染空气;
(2)氧气的检验方法是:将带火星的木条靠近管口a,若木条复燃,说明有氧气生成,否则没有,
故答案为:将带火星的木条靠近管口a,若木条复燃,说明有氧气生成;
(3)亚硫酸钠和氯化钡反应生成亚硫酸钡,硝酸有强氧化性,能把亚硫酸钡氧化生成硫酸钡,干扰了亚硫酸根离子的检验,所以该方案不合理,
故答案为:否;稀硝酸能将生成的BaSO3 氧化为BaSO4而使沉淀不溶于稀硝酸;
(4)要验证固体中是否有Na2SO3和Na2SO4,可以检验SO32-与SO42-,实验方案为:
取少量C中固体产物于试管中,加入适量的蒸馏水溶解,加过量的1 mol?L-1BaCl2溶液,若产生白色沉淀,则证明有Na2SO3或Na2SO4;继续滴加适量的1 mol?L-1的稀盐酸,若白色沉淀部分溶解,并产生剌激性气味气体,则证明有Na2SO3和Na2SO4,(或:取少量C中固体产物于试管中,加入适量的蒸馏水溶解,滴加过量的1 mol?L-1稀盐酸,若产生剌激性气味气体,则证明有Na2SO3;继续滴加适量的1 mol?L-1BaCl2溶液,若产生白色沉淀,则证明有Na2SO4.);
故答案为:
或
故答案为:干燥二氧化硫,防止较多的水蒸气与过氧化钠反应;防止空气中的水和二氧化碳进入C装置与过氧化钠反应,同时吸收过量的二氧化硫,以免污染空气;
(2)氧气的检验方法是:将带火星的木条靠近管口a,若木条复燃,说明有氧气生成,否则没有,
故答案为:将带火星的木条靠近管口a,若木条复燃,说明有氧气生成;
(3)亚硫酸钠和氯化钡反应生成亚硫酸钡,硝酸有强氧化性,能把亚硫酸钡氧化生成硫酸钡,干扰了亚硫酸根离子的检验,所以该方案不合理,
故答案为:否;稀硝酸能将生成的BaSO3 氧化为BaSO4而使沉淀不溶于稀硝酸;
(4)要验证固体中是否有Na2SO3和Na2SO4,可以检验SO32-与SO42-,实验方案为:
取少量C中固体产物于试管中,加入适量的蒸馏水溶解,加过量的1 mol?L-1BaCl2溶液,若产生白色沉淀,则证明有Na2SO3或Na2SO4;继续滴加适量的1 mol?L-1的稀盐酸,若白色沉淀部分溶解,并产生剌激性气味气体,则证明有Na2SO3和Na2SO4,(或:取少量C中固体产物于试管中,加入适量的蒸馏水溶解,滴加过量的1 mol?L-1稀盐酸,若产生剌激性气味气体,则证明有Na2SO3;继续滴加适量的1 mol?L-1BaCl2溶液,若产生白色沉淀,则证明有Na2SO4.);
故答案为:
| 实验步骤 | 预期现象和结论 |
| ①取少量C中固体产物于试管中,加入适量的蒸馏水溶解 | |
| ②滴加过量的1 mol?L-1BaCl2溶液 | 若产生白色沉淀,则证明有Na2SO3或Na2SO4 |
| ③滴加适量的1 mol?L-1的稀盐酸 | 若白色沉淀部分溶解,并产生剌激性气味气体,则证明有Na2SO3和Na2SO4. |
| 实验步骤 | 预期现象和结论 |
| ①取少量C中固体产物于试管中,加入适量的蒸馏水溶解 | |
| ②滴加过量的1 mol?L-1稀盐酸 | 若产生剌激性气味气体,则证明有Na2SO3 |
| ③滴加适量的1 mol?L-1BaCl2溶液 | 若产生白色沉淀,则证明有Na2SO4. |
点评:本题考查了物质的性质实验设计,为高频考点,侧重于学生的分析能力的考查,注意把握实验的原理,难度不大,会根据题中给予信息分析问题、解决问题.

练习册系列答案
 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
设NA代表阿伏加德罗常数的数值,下列说法中正确的是( )
| A、常温常压下,17g-14CH3所含的中子数为9NA |
| B、39g钾发生氧化还原反应时,一定失去NA个电子 |
| C、标准状况时,22.4L二氯甲烷所含有的分子数为NA |
| D、常温常压下,1mol氦气含有的核外电子数为 4NA |
下列描述正确的是( )
| A、在pH=1溶液中,NH+4、K+、ClO-、Cl-可以大量共存 |
| B、MgO可以除去MgCl2溶液中的FeCl3 |
| C、足量铁粉与稀硝酸反应:Fe+4H++NO3-=Fe3++NO↑+2H2O |
| D、向某溶液滴加盐酸酸化的氯化钡溶液,出现白色沉淀,则证明该溶液中含有SO42- |
酸性高锰酸钾溶液与草酸溶液反应的化学方程式为:2KMnO4+3H2SO4+5H2C2O4═K2SO4+2MnSO4+10CO2↑+8H2O不能使反应速率加大的措施是( )
| A、增大酸性高锰酸钾溶液的浓度 |
| B、增大草酸溶液的浓度 |
| C、增大压强 |
| D、升高温度 |

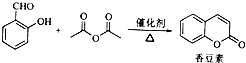
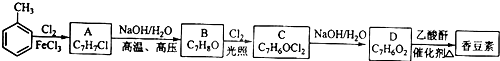
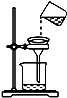 现有含NaCl、MgCl2和Na2SO4的混合溶液,某兴趣小组的同学欲提取纯净的NaCl晶体,设计了如下实验:
现有含NaCl、MgCl2和Na2SO4的混合溶液,某兴趣小组的同学欲提取纯净的NaCl晶体,设计了如下实验: