题目内容
20.在Na2O2与水反应中,叙述正确的是( )| A. | O2是还原产物 | |
| B. | NaOH是氧化产物 | |
| C. | Na2O2中,-1价的氧既得电子,又失电子 | |
| D. | Na2O2是氧化剂,水是还原剂 |
分析 Na2O2与水发生反应:2Na2O2+2H2O═4NaOH+O2↑,其反应实质为Na2O2+2H2O═2NaOH+H2O2,2H2O2═2H2O+O2↑,反应中只有氧元素的化合价发生变化,由Na2O2中-1价降低为H2O中-2价,升高为O2中0价,以此来解答.
解答 解:Na2O2与水发生反应:2Na2O2+2H2O═4NaOH+O2↑,其反应实质为Na2O2+2H2O═2NaOH+H2O2,2H2O2═2H2O+O2↑,反应中只有氧元素的化合价发生变化,由Na2O2中-1价降低为H2O中-2价,升高为O2中0价,
A.氧元素化合价由Na2O2中-1价升高为O2中0价,氧气为氧化产物,故A错误;
B.NaOH中所含元素化合价为发生变化,NaOH既不是氧化产物也不是还原产物,故B错误;
C.由Na2O2中氧元素化合价由-1价降低为H2O中-2价,升高为O2中0价,Na2O2中-1价的氧既得电子,又失电子,故C正确;
D.过氧化钠中的O元素为-1价,在反应中既升高又降低,Na2O2既是氧化剂又是还原剂,水既不是氧化剂也不是还原剂,故D错误;
故选C.
点评 本题考查氧化还原反应基本概念,难度不大,把握过氧化钠与水反应的实质是解题关键,注意从化合价角度分析氧化还原反应.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.下列化学反应中观察不到颜色变化的是( )
| A. | 往品红溶液中通入SO2 | B. | NO中混入空气 | ||
| C. | 往氨水中滴加酚酞 | D. | 往Ba(OH)2溶液中滴加盐酸 |
8.镍是有机合成的重要催化剂,某化工厂有含镍催化剂废品(主要成分是镍、杂质是铁、铝单质及其化合物,还有少量难溶性杂质).某学习小组设计如下流程利用含镍催化剂废品制备硫酸镍晶体:

几种难溶碱开始沉淀和完全沉淀的pH:
回答下列问题:
(1)溶液①中含金属元素的离子是AlO2-.
(2)用离子方程式表示加入双氧水的目的2Fe2++H2O2+2H+=2Fe3++2H2O;双氧水可以用下列物质替代的是A.
A.氧气 B.漂白液 C.氯气 D.硝酸
(3)操作a和c需要共同的玻璃仪器是玻璃棒;操作C的名称是蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(4)如果加入双氧水量不足或“保温时间较短”,则所制备的产品可能含有的杂质为产品中混有绿矾;请选择合适的试剂,设计实验证明产品中是否含“杂质”取少量样品溶于蒸馏水,滴加酸性高锰酸钾溶液,若溶液紫色褪去,则产品中含有亚铁离子.
(5)含镍金属氢化物MH-Ni燃料电池是一种绝色环保电池,广泛应用于电动汽车.其中M代表储氢合金,MH代表金属氢化物,电解质溶液可以是KOH水溶液.它的充、放电反应为:xNi(OH)2+M $?_{放电}^{充电}$ MHx+xNiOOH;电池充电过程中阳极的电极反应式为Ni(OH)2+OH--e-=NiOOH+H2O,放电时负极的电极反应式为MHx+xOH--xe-=M++xH2O.

几种难溶碱开始沉淀和完全沉淀的pH:
| 沉淀物 | 开始沉淀 | 完全沉淀 |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
(1)溶液①中含金属元素的离子是AlO2-.
(2)用离子方程式表示加入双氧水的目的2Fe2++H2O2+2H+=2Fe3++2H2O;双氧水可以用下列物质替代的是A.
A.氧气 B.漂白液 C.氯气 D.硝酸
(3)操作a和c需要共同的玻璃仪器是玻璃棒;操作C的名称是蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(4)如果加入双氧水量不足或“保温时间较短”,则所制备的产品可能含有的杂质为产品中混有绿矾;请选择合适的试剂,设计实验证明产品中是否含“杂质”取少量样品溶于蒸馏水,滴加酸性高锰酸钾溶液,若溶液紫色褪去,则产品中含有亚铁离子.
(5)含镍金属氢化物MH-Ni燃料电池是一种绝色环保电池,广泛应用于电动汽车.其中M代表储氢合金,MH代表金属氢化物,电解质溶液可以是KOH水溶液.它的充、放电反应为:xNi(OH)2+M $?_{放电}^{充电}$ MHx+xNiOOH;电池充电过程中阳极的电极反应式为Ni(OH)2+OH--e-=NiOOH+H2O,放电时负极的电极反应式为MHx+xOH--xe-=M++xH2O.
15.在一定温度下,将nmolPCl5通入定容的密闭容器中,达平衡,反应为:PCl5(g)?PCl3(g)+Cl2(g),测得压强为P1,若再向容器中通入nmolPCl5,又达平衡后,压强为P2,则下列关系式正确的是( )
| A. | P1=2P2 | B. | 2P1=P2 | C. | P1<P2<2P1 | D. | 2P1<P2 |
5.下列叙述中不正确的是( )
| A. | 用SiO2制备硅酸不可能一步完成 | |
| B. | 使用澄清的石灰水可以鉴别Na2CO3和NaHCO3两种白色固体 | |
| C. | 把铁粉和铜粉放入FeCl3溶液充分反应后有固体剩余,固体中可能有铜无铁 | |
| D. | 烧碱溶液应保存在塞有橡胶塞的细口玻璃瓶中 |
12.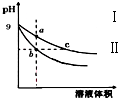 常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,平衡时pH随溶液体积变化的曲线如图所示,则下列叙述正确的是( )
常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,平衡时pH随溶液体积变化的曲线如图所示,则下列叙述正确的是( )
 常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,平衡时pH随溶液体积变化的曲线如图所示,则下列叙述正确的是( )
常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,平衡时pH随溶液体积变化的曲线如图所示,则下列叙述正确的是( )| A. | b、c两点溶液的导电能力相同 | |
| B. | a、b、c三点溶液中水的电离程度a>c>b | |
| C. | c点溶液中c (H+)=c (OH-)+c (CH3COOH) | |
| D. | 用等浓度的盐酸分别与等体积的b、c处溶液恰好完全反应,消耗盐酸体积 Vb=Vc |
9.下列仪器对应的名称正确的是 ( )
| A. |  三脚架 | B. |  酸式滴定管 酸式滴定管 | C. |  长颈漏斗 | D. |  蒸发皿 |