题目内容
15.在一定温度下,将nmolPCl5通入定容的密闭容器中,达平衡,反应为:PCl5(g)?PCl3(g)+Cl2(g),测得压强为P1,若再向容器中通入nmolPCl5,又达平衡后,压强为P2,则下列关系式正确的是( )| A. | P1=2P2 | B. | 2P1=P2 | C. | P1<P2<2P1 | D. | 2P1<P2 |
分析 容积固定,达平衡后再向容器中充入nmolPCl5,相当于将两个相同条件下得到平衡状态的且容积不变的容器合并为一个容器,混合气体的压强增大,平衡会向左移动,由此分析解答.
解答 解:容积固定,达平衡后再向容器中充入nmolPCl5,相当于将两个相同条件下得到平衡状态的且容积不变的容器合并为一个容器,混合气体的压强增大,平衡会向左移动,移动结果只能减弱但不能抵消,所以压强为P2比2P1小,但比P1大,则P1<P2<2P1,故选C.
点评 本题考查压强对化学平衡的影响,注意容器容积不变,气体物质的量增大压强增大,本题难度中等.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案
相关题目
10.下列气体组(括号内为混有的少量杂质),最适宜用CuSO4溶液进行提纯的是( )
| A. | HCl(H2S) | B. | O2(N2) | C. | CO(H2S) | D. | H2S(HCl) |
3. 已知25℃时有关弱酸的电离平衡常数:
已知25℃时有关弱酸的电离平衡常数:
(1)同温度下,等pH值的a.NaHCO3 b.NaCN c.Na2CO3溶液的物质的量浓度由大到小的顺序为a>b>c(填序号).
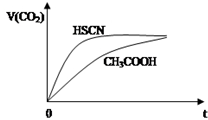
(2)25℃时,将20mL 0.1mol•L-1CH3COOH溶液和20mL 0.1mol•L-1HSCN溶液分别与20mL 0.1mol•L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是:相同温度下HSCN比CH3COOH的电离平衡常数大,同浓度时电离出的氢离子浓度大,与NaHCO3溶液反应快.反应结束后所得两溶液中,c(SCN-)>c(CH3COO-)(填“>”、“<”或“=”)
(3)若保持温度不变,在醋酸溶液中加入一定量氨气,下列量会变小的是b(填序号)
a.c(CH3COO-) b.c(H+) c.KW d.醋酸电离平衡常数.
 已知25℃时有关弱酸的电离平衡常数:
已知25℃时有关弱酸的电离平衡常数:| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
(2)25℃时,将20mL 0.1mol•L-1CH3COOH溶液和20mL 0.1mol•L-1HSCN溶液分别与20mL 0.1mol•L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是:相同温度下HSCN比CH3COOH的电离平衡常数大,同浓度时电离出的氢离子浓度大,与NaHCO3溶液反应快.反应结束后所得两溶液中,c(SCN-)>c(CH3COO-)(填“>”、“<”或“=”)
(3)若保持温度不变,在醋酸溶液中加入一定量氨气,下列量会变小的是b(填序号)
a.c(CH3COO-) b.c(H+) c.KW d.醋酸电离平衡常数.
10.在硫酸溶液中,NaClO3和Na2SO3能按物质的量之比l:2完全反应,生成一种棕黄色气体X,同时Na2SO3被氧化为Na2SO4,则X为( )
| A. | Cl2 | B. | Cl2O | C. | ClO2 | D. | Cl2O7 |
20.在Na2O2与水反应中,叙述正确的是( )
| A. | O2是还原产物 | |
| B. | NaOH是氧化产物 | |
| C. | Na2O2中,-1价的氧既得电子,又失电子 | |
| D. | Na2O2是氧化剂,水是还原剂 |
7.某溶液含有K+、Fe3+、SO$\stackrel{2-}{4}$、OH-、I-中的几种.取样,滴加KSCN溶液后显红色.为确定该溶液的组成,还需检验的离子是( )
| A. | K+ | B. | I- | C. | SO$\stackrel{2-}{4}$ | D. | CO$\stackrel{2-}{3}$ |
4.下列关于钠的说法不正确的是( )
| A. | 钠质软,可用小刀切割 | |
| B. | 钠要保存在煤油或者石蜡油中 | |
| C. | 钠着火可用干沙扑灭 | |
| D. | 钠与氧气反应,产物是由氧气的量决定的 |
5.已知硫酸铅难溶于水,也难溶于硝酸,却可溶于醋酸铵溶液中,形成无色的溶液,其化学方程式是:PbSO4+2CH3COONH4═(CH3COO)2Pb+(NH4)2SO4.当醋酸铅溶液中通入H2S时,有黑色沉淀PbS和弱电解质CH3COOH生成,表示这个反应的有关离子方程式正确的是( )
| A. | Pb2++2CH3COO-+2H++S2-═PbS↓+2CH3COOH | |
| B. | Pb2++H2S═PbS↓+2H+ | |
| C. | Pb2++2CH3COO-+H2S═PbS↓+2CH3COOH | |
| D. | (CH3COO)2Pb+H2S═PbS↓+2CH3COOH |

