题目内容
19. CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中由于哑铃形的C22-存在,使晶胞沿一个方向拉长.下列关于CaC2晶体的说法中正确的是( )
CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中由于哑铃形的C22-存在,使晶胞沿一个方向拉长.下列关于CaC2晶体的说法中正确的是( )| A. | 1 个 Ca2+周围距离最近且等距离的 C22-数目为 6 | |
| B. | 该晶体中的阴离子与F2是等电子体 | |
| C. | 6.4 g CaC2晶体中含阴离子0.1 mol | |
| D. | 与每个Ca2+距离相等且最近的Ca2+共有12个 |
分析 A.1个Ca2+周围距离最近且等距离的C22-应位于同一平面,注意使晶胞沿一个方向拉长的特点;
B.C22-含电子数为2×6+2=14,F2的电子数为18;
C.CaC2晶体中含阴离子为C22-,6.4克CaC2为0.1mol;
D.与每个Ca2+距离相等且最近的Ca2+共有4个.
解答 解:A.依据晶胞示意图可以看出,晶胞的一个平面的长与宽不相等,再由图中体心可知1个Ca2+周围距离最近的C22-有4个,而不是6个,故A错误;
B.C22-含电子数为2×6+2=14,F2的电子数为18,二者电子数不同,不是等电子体,故B错误;
C.6.4克CaC2为0.1mol,CaC2晶体中含阴离子为C22-,则含阴离子0.1mol,故C正确;
D.晶胞的一个平面的长与宽不相等,与每个Ca2+距离相等且最近的Ca2+应为4个,故D错误.
故选:C.
点评 本题考查晶胞的分析,题目难度中等,注意使晶胞沿一个方向拉长的特点,为解答该题的关键,易错点为A和D.

练习册系列答案
相关题目
9.下列比较金属性相对强弱的方法或依据正确的是( )
| A. | 根据金属失去电子的多少来判断,失去电子较多的金属性较强 | |
| B. | 用钠置换MgCl2溶液中的Mg2+,来验证钠的金属性强于Mg | |
| C. | Mg不与NaOH溶液反应而Al能与NaOH溶液反应,可说明金属性:Al>Mg | |
| D. | 碱性:NaOH>Mg(OH)2>Al(OH)3,可说明钠、镁、铝金属性依次减弱 |
10.设阿伏加德罗常数为NA,则下列说法正确的是( )
| A. | 16g甲烷所含有的电子数是8NA | |
| B. | 常温常压下,4g氦气所含有的原子数目为NA | |
| C. | 标准状况下,1L己烷充分燃烧后生成CO2分子数为3/11.2 NA | |
| D. | 常温常压下,1mol丙烷所含有的共价键数目为2NA |
7.达菲(Tamiflu)被认为是目前世界上公认的能够治疗禽流感的唯一有效的药物,它是以我国特有药材八角的提取物--莽草酸(shikimicacid)为原料合成的.已知莽草酸和达菲的结构简式如下:下列判断正确的是( )
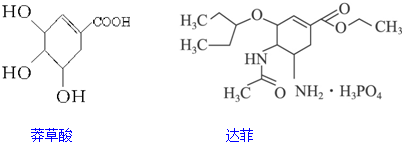

| A. | 它们互为同系物 | |
| B. | 莽草酸和达菲都能使溴的四氯化碳溶液褪色 | |
| C. | 达菲在热的NaOH溶液中能稳定存在 | |
| D. | 1 mol莽草酸可与4 mol NaOH反应 |
14.下列过程属于物理变化的是( )
| A. | 油脂的水解 | B. | 乙酸的酯化 | C. | 石蜡油的分解 | D. | 石油的分馏 |
11.某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示,下列说法正确的是( )
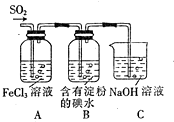

| A. | SO42-是SO2气体与Fe3+反应的还原产物 | |
| B. | 装置C烧杯中加入少量苯可以防止倒吸 | |
| C. | 表明I-的还原性弱于SO2的现象是B中溶液蓝色褪色 | |
| D. | 在A中的溶液加入KMnO4溶液,则紫红色褪去说明A中SO2与Fe3+发生了氧化还原反应 |
8.a、b、c、d四种元素在周期表中的位置如图,则下列说法正确的是( )
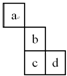

| A. | 若b的最高价氧化物对应水化物为H2bO4,则a的氢化物的化学式为aH3 | |
| B. | 若a的核电荷数为z,则b的核电荷数一定为z+8 | |
| C. | 最高价氧化物对应水化物的碱性强弱:b>c | |
| D. | a与b之间容易形成离子化合物 |
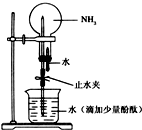 有关氨的实验室制取和性质实验如下:
有关氨的实验室制取和性质实验如下: .
.