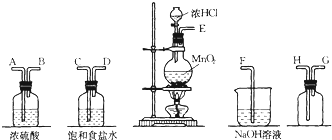
题目内容
7.在反应3Cl2+8NH3=6NH4Cl+N2中,发生氧化与还原反应的分子个数比是( )| A. | 2:3 | B. | 3:2 | C. | 3:8 | D. | 8:3 |
分析 反应8NH3+3Cl2=N2+6NH4Cl中,N元素化合价升高,由-3价升高到0价,Cl元素化合价降低,由0价降低到-1价,氧化还原反应中,氧化剂和还原剂之间得失电子数目相等,表现为化合价升降总数相等,也可根据化合价的变化结合方程式判断,以此解答该题.
解答 解:反应8NH3+3Cl2=N2+6NH4Cl中,N元素化合价升高,由-3价升高到0价,Cl元素化合价降低,由0价降低到-1价,
由方程式可知当有3molCl2参加反应时,有8molNH3参加反应,其中有2mol被氧化,
则被氧化物质即发生氧化反应与被还原物质即发生还原反应分子数之比为2:3,
故选A.
点评 本题考查氧化还原反应,注意从元素化合价变化的角度认识氧化还原反应中相关概念和物质的性质,题目难度不大.

练习册系列答案
相关题目
17.某同学学完《化学1》的知识后得出下列结论,其中正确的是( )
| A. | 将NaH溶于水,得到的水溶液能导电,由此可说明NaH是离子化合物 | |
| B. | Fe(OH)3胶体和Fe(OH)3沉淀的物理性质不同但化学性质基本相同 | |
| C. | CO2、SO2、SiO2、NO2等都是酸性氧化物;Na2O、MgO、A2lO3等都是碱性氧化物 | |
| D. | MnO2具有较强氧化性,可作为H2O2分解反应的氧化剂 |
18.对食物的酸、碱性判断正确的是( )
| A. | 西瓜是酸性食物 | B. | 猪肉、牛肉是碱性食物 | ||
| C. | 鱿鱼、奶油是酸性食物 | D. | 大米、面包是碱性食物 |
2.最先发现电子的科学家是( )
| A. | 道尔顿 | B. | 玻尔 | C. | 汤姆生 | D. | 卢瑟福 |
19.将5mol/L的盐酸10mL稀释到100mL,再从中取出5mL,这5mL溶液的物质的量浓度为( )
| A. | 0.75 mol/L | B. | 0.25 mol/L | C. | 0.5 mol/L | D. | 1 mol/L |
16.下列说法正确的是( )
| A. | KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质 | |
| B. | Na2SO3溶液中:c(H+)+c(HSO3-)+c(H2SO3)═c(OH-) | |
| C. | 向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 | |
| D. | 向含有AgCl固体的溶液中加入适量水使AgCl溶解又达到平衡时,在该温度下AgCl的溶度积不变,其溶解度也不变 |
17. 在2L密闭容器中进行反应3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g)△H>0测得n(H2O)随反应时间(t)的变化如图所示.下列判断正确的是( )
在2L密闭容器中进行反应3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g)△H>0测得n(H2O)随反应时间(t)的变化如图所示.下列判断正确的是( )
 在2L密闭容器中进行反应3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g)△H>0测得n(H2O)随反应时间(t)的变化如图所示.下列判断正确的是( )
在2L密闭容器中进行反应3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g)△H>0测得n(H2O)随反应时间(t)的变化如图所示.下列判断正确的是( )| A. | 该反应的化学平衡常数表达式为K=c4(H2O)/c4(H2) | |
| B. | 5min时该反应的υ(正)等于9min时的υ(逆) | |
| C. | 0~5min内,υ(H2)=0.10mol/(L•min) | |
| D. | 10min时平衡发生移动可能是投入还原性铁粉引起 |
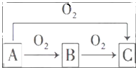 A、B、C是中学化学中常见的三种物质,它们之间的相互转化关系如图(部分反应条件及产物略去):
A、B、C是中学化学中常见的三种物质,它们之间的相互转化关系如图(部分反应条件及产物略去):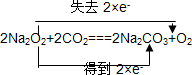 ,并用双线桥法表示上述反应中电子转移的方向和数目,如此反应转移0.5mol电子时,生成物中气体在标准状况下的体积为5.6L.如在AlCl3溶液中投入足量的(1)中的C物质,则反应的离子方程式为2Na2O2+Al3+═AlO2-+O2↑+4Na+.
,并用双线桥法表示上述反应中电子转移的方向和数目,如此反应转移0.5mol电子时,生成物中气体在标准状况下的体积为5.6L.如在AlCl3溶液中投入足量的(1)中的C物质,则反应的离子方程式为2Na2O2+Al3+═AlO2-+O2↑+4Na+.