题目内容
12.在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气.进行此实验,所用仪器如图:(1)连接上述仪器的正确顺序是:E接C,D接A,B接H,G接F.
(2)气体发生装置中进行的反应化学方程式是4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;当0.5mol MnO2参与反应时,被氧化的HCl的质量为36.5g,生成的Cl2在标准状况下的体积约为11.2L.
(3)在装置中:①饱和食盐水的作用是除去Cl2中的HCl,②浓硫酸的作用是干燥氯气.
(4)化学实验中检验是否有Cl2产生常用湿润的淀粉-KI试纸.如果有Cl2产生,可观察到的现象是试纸变蓝,写出反应方程式Cl2+2KI=I2+2KCl.
(5)写出尾气吸收装置中进行的反应的化学方程式Cl2+2NaOH=NaCl+NaClO+H2O.
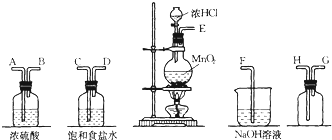
分析 (1)在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气,需要发生装置生成氯气,用饱和食盐水除去氯化氢,通过浓硫酸除去水蒸气,导气管长进短处收集氯气,最后用氢氧化钠溶液吸收多余的氯气;
(2)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水;反应中消耗1mol二氧化锰,有2mol氯化氢被氧化,生成1mol氯气,据此解答;
(3)浓盐酸易挥发,制取的氯气中含有氯化氢和水蒸气,依据氯气、氯化氢的溶解性选择合适的除杂剂,依据浓硫酸具有吸水性,选择浓硫酸做干燥剂,干燥氯气;
(4)氯气具有强的氧化性,能够氧化碘化钾生成单质碘,碘遇到淀粉变蓝;
(5)氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水.
解答 解:(1)在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气,需要发生装置生成氯气,用饱和食盐水除去氯化氢,通过浓硫酸除去水蒸气,导气管长进短处收集氯气,最后用氢氧化钠溶液吸收多余的氯气,装置连接顺序是 E C D A B H G F,
故答案为:C D A B H G;
(2)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水,化学方程式:4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;反应中消耗1mol二氧化锰,有2mol氯化氢被氧化,生成1mol氯气,所以当0.5mol MnO2参与反应时,被氧化的HCl的质量为1mol,质量为36.5g;生成氯气的物质的量为0.5mol,标况下气体的体积为0.5mol×22.4L/mol=11.2L;
故答案为:4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O; 36.5g; 11.2L;
(3)盐酸易挥发,制取的氯气中含有氯化氢和水蒸气,氯气在饱和食盐水中溶解度不大,氯化氢易溶于水,选择饱和食盐水除去氯气中的氯化氢;
浓硫酸具有吸水性,选择浓硫酸做干燥剂,干燥氯气;
故答案为:①除去Cl2中的HCl; ②干燥氯气;
(4)氯气具有强的氧化性,能够氧化碘化钾生成单质碘,化学方程式:;Cl2+2 KI=I2+2 KCl,碘遇到淀粉变蓝;
故答案为:试纸变蓝;Cl2+2 KI=I2+2 KCl;
(5)氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,化学方程式:Cl2+2 NaOH=NaCl+NaClO+H2O;
故答案为:Cl2+2 NaOH=NaCl+NaClO+H2O.
点评 本题考查了实验室制备干燥纯净的氯气的实验步骤和试剂选择,明确制备原理和氯气的性质是解题关键,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | ${\;}_{27}^{60}$Co原子核内含有60个质子 | |
| B. | Co-59和Co-60质子数相同,两者可互称为同位素 | |
| C. | ${\;}_{27}^{59}$Co原子核内含有22个中子 | |
| D. | ${\;}_{27}^{60}$Co原子的最外层电子数为27 |
| A. | MnO2与浓盐酸反应制Cl2:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl-+Cl2↑+2H2O | |
| B. | 明矾溶于水产生Al(OH)3胶体:Al3++3H2O=Al(OH)3↓+3H+ | |
| C. | Na2O2溶于水产生O2:Na2O2+H2O=2Na++2OH-+O2↑ | |
| D. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O |
| A. | 2:3 | B. | 3:2 | C. | 3:8 | D. | 8:3 |
| A. | 1 mol CH3COOK的质量为98 g•mol-1 | |
| B. | CH3COOK的摩尔质量等于它的相对分子质量 | |
| C. | 一个CH3COOK微粒的质量约为98 g/NA | |
| D. | 含有6.02×1023个碳原子的CH3COOK的物质的量为1 mol |
| A. | 限制生产含磷洗衣剂-防止湖海出现“赤潮” | |
| B. | 严禁排放未经处理的有毒工业废水-防止水土流失 | |
| C. | 不允许焚烧农作物秸秆-防止污染空气 | |
| D. | 限制生产不符合尾气排放标准的汽车-防止氮氧化物污染空气 |
| A. | 冰融化 | B. | 光合作用 | C. | 白炽灯发光 | D. | 焰色反应 |
(1)该工艺流程中多处涉及到过滤操作,其需要用到的玻璃仪器主要有烧杯、玻璃棒、(普通)漏斗.
(2)假设所得反应Ⅰ的滤液中各种金属阳离子的浓度均为0.001mol/L( 查数据可知部分难溶物的溶度积Ksp数值如下表所示(25℃))
| 难溶物 | 溶度积Ksp |
| Mg(OH)2 | 1.8×10-11 |
| Al(OH)3 | 1.0×10-33 |
| Fe(OH)3 | 8.0×10-38 |
②当Fe3+恰好沉淀完全时溶液的PH值为3.3.(已知:lg2=0.3)
(3)反应Ⅲ中生成Al(OH)3沉淀的离子方程式是AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓.
(4)实验室用酸碱滴定法测定硅藻土中硅含量的步骤如下:
步骤1:准确称取样品a g,加入适量KOH固体,在高温下充分灼烧,冷却,加水溶解.
步骤2:将所得溶液完全转移至塑料烧杯中,加入硝酸至强酸性,得硅酸浊液.
步骤3:向硅酸浊液中加入NH4F溶液、饱和KCl溶液,得K2SiF6沉淀,用塑料漏斗过滤并洗涤.
步骤4:将K2SiF6转移至另一烧杯中,加入一定量蒸馏水,采用70℃水浴加热使其充分水解(K2SiF6+3H2O=H2SiO3+4HF+2KF).
步骤5:向上述水解液中加入数滴酚酞,趁热用浓度为c mol/L NaOH的标准溶液滴定至终点,消耗NaOH标准溶液V mL.
①步骤3中采用饱和KCl溶液洗涤沉淀,其目的是洗去沉淀表面的HF等杂质;增大K+浓度,减少K2SiF6的损失.
②步骤5中判断滴定终点的现象是最后一滴滴入后溶液由无色变为粉红色,且30s不褪色.
③已知样品中SiO2的质量分数可用公式“w(SiO2)=$\frac{15cV×1{0}^{-3}}{a}$×100%”进行计算.
由此分析步骤5中与NaOH标准溶液发生中和反应的酸为B.
A.H2SiO3 B.HF C.H2SiO3和HF D.无法确定

 为测定NaOH、Na2C03混合物中Na2C03的质量分数,甲同学拟采用图(1)所示装置来测定.乙同学拟采用图(2)所示装置来测定.请回答下列问题:
为测定NaOH、Na2C03混合物中Na2C03的质量分数,甲同学拟采用图(1)所示装置来测定.乙同学拟采用图(2)所示装置来测定.请回答下列问题: