题目内容
16.下列溶液中的氯离子浓度与50mL 1mol/L的AlCl3溶液中氯离子浓度相等的是( )| A. | 75 mL 2 mol/L的CaCl2 | B. | 100 mL 2 mol/L的NH4Cl | ||
| C. | 150 mL 1mol/L的KCl | D. | 100 mL 3 mol/L的NaCl |
分析 根据离子的物质的量浓度=溶质的物质的量浓度×溶质中含有离子的个数,与溶液的体积无关来分析.
解答 解:50mL 1mol•L-1的AlCl3溶液中氯离子的物质的量浓度为1mol•L-1×3=3mol•L-1,
A、75mL 2mol•L-1的CaCl2溶液中氯离子的物质的量浓度为2mol•L-1×2=4mol•L-1,故A错误;
B、100mL 2mol•L-1的NH4Cl溶液中氯离子的物质的量浓度为2mol•L-1×1=2mol•L-1,故B错误;
C、150mL 1mol•L-1的KCl溶液中氯离子的物质的量浓度为1mol•L-1×1=1mol•L-1,故C错误;
D、100mL 3mol•L-1的NaCl溶液中氯离子的物质的量浓度为3mol•L-1×1=3mol•L-1,故D正确;
故选D.
点评 本题考查物质的量浓度的计算与理解,题目难度不大,注意溶液中溶质离子的浓度与溶液体积无关,只取决于物质电离出的离子的数目多少与溶质的浓度.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
9.将4.3gNa、Na2O、Na2O2的混合物与足量水反应,在标准状况下得到672ml混合气体,将该混合气体通过放电恰好反应,则原混合物中Na、Na2O、Na2O2的物质的量之比为( )
| A. | 1:2:1 | B. | 1:1:1 | C. | 1:3:1 | D. | 4:3:2 |
9.我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流.电池总反应为:4A1+3O2+6H2O=4A1(OH)3,下列说法不正确的是( )
| A. | 电池工作时,电流由铝电极沿导线流向铂电极 | |
| B. | O2在正极发生还原反应 | |
| C. | 以网状的铂为正极,可增大与氧气的接触面积 | |
| D. | 该电池通常只需更换铝板就可继续使用 |
4.除去下列物质中的少量杂质(括号内的物质为杂质),所选出的试剂或方法不正确的是( )
| A. | CO2(SO2):饱和碳酸氢钠溶液 | B. | CuCl2溶液(FeCl3):CuO | ||
| C. | Al2O3(SiO2):NaOH溶液 | D. | Na2CO3固体(NaHCO3):加热 |
11.胶体遇到强电解质会发生聚沉,将某溶液逐滴加入Fe(OH)3胶体(胶粒带正电荷)中,开始时产生沉淀,继续滴加则沉淀溶解,那么该溶液是( )
| A. | 2 mol•L-1 NaOH溶液 | B. | 2 mol•L-1HCl溶液 | ||
| C. | 2 mol•L-1NaCl溶液 | D. | 硅酸胶体(胶粒带负电荷) |
5.将500ml含有BaCl2和KCl的混合溶液分成10 等份,取一份加入含amol硫酸钠的溶液,恰好使钡离子完全沉淀,另取一份加入含bmol硝酸银的溶液,恰好使氯离子完全沉淀.则该混合溶液中钾离子的浓度为( )
| A. | 0.2(b-2a)mol•L-1 | B. | 20(b-2a)mol•L-1 | C. | 20 (b-a) mol•L-1 | D. | 20(2a-b) mol•L-1 |

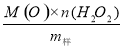 ×100来衡量其优劣,13%以
×100来衡量其优劣,13%以 上为优等品。一种制备过碳酸钠的工艺流程如图:
上为优等品。一种制备过碳酸钠的工艺流程如图: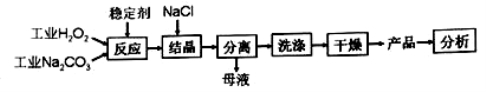
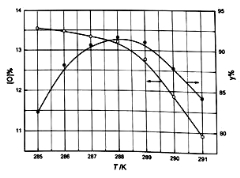
 ___.
___.