题目内容
13.下列关于有机化合物的结构、性质的叙述正确的是( )| A. | 糖类、油脂、蛋白质的水解产物都是非电解质 | |
| B. | 蔗糖、麦芽糖的分子式均为C12H22O11,二者互为同分异构体 | |
| C. | 甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应 | |
| D. | 乙醇、乙酸分子中均含有官能团-OH,所以均能与NaOH溶液反应 |
分析 A.油脂水解生成高级脂肪酸,蛋白质可水解生成氨基酸,可电离出氢离子;
B.蔗糖、麦芽糖的分子式相同,但结构不同;
C.甲烷与氯气发生取代反应,乙烯和溴发生加成反应;
D.乙醇与氢氧化钠不反应.
解答 解:A.油脂水解生成高级脂肪酸,蛋白质可水解生成氨基酸,可电离出氢离子,属于电解质,故A错误;
B.蔗糖、麦芽糖的分子式相同,但结构不同,二者属于同分异构体,故B正确;
C.甲烷与氯气发生取代反应,乙烯和溴发生加成反应,反应类型不同,故C错误;
D.乙醇与氢氧化钠不反应,乙酸含有羧基,具有酸性,可与氢氧化钠溶液反应,故D错误.
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重常见有机物的结构、性质及有机反应的考查,题目难度不大.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
3.氢硫酸中加入或通入少量下列物质,溶液酸性增强的是( )
| A. | O2 | B. | Cl2 | C. | SO2 | D. | NaOH |
4.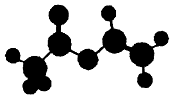 法国、美国、荷兰的三位科学家因研宄“分子机器的设计与合成”获得2016年诺贝尔化学奖.轮烷是一种分子机器的“轮子”,轮烷的一种合成原料由C、H、O三种元素组成,其球棍模型如图所示,下列说法正确的是( )
法国、美国、荷兰的三位科学家因研宄“分子机器的设计与合成”获得2016年诺贝尔化学奖.轮烷是一种分子机器的“轮子”,轮烷的一种合成原料由C、H、O三种元素组成,其球棍模型如图所示,下列说法正确的是( )
 法国、美国、荷兰的三位科学家因研宄“分子机器的设计与合成”获得2016年诺贝尔化学奖.轮烷是一种分子机器的“轮子”,轮烷的一种合成原料由C、H、O三种元素组成,其球棍模型如图所示,下列说法正确的是( )
法国、美国、荷兰的三位科学家因研宄“分子机器的设计与合成”获得2016年诺贝尔化学奖.轮烷是一种分子机器的“轮子”,轮烷的一种合成原料由C、H、O三种元素组成,其球棍模型如图所示,下列说法正确的是( )| A. | 该化合物的名称为乙酸乙酯 | |
| B. | 该化合物与Br2的四氯化碳溶液不反应 | |
| C. | 该化合物既能发生水解反应,又能发生氧化反应 | |
| D. | 该化合物的同分异构体中,能与NaHCO3反应放出CO2的只有2种 |
1.下列反应属于氧化还原反应,且能量变化如图所示的是( )
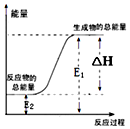

| A. | 锌粒和稀硫酸反应 | |
| B. | 灼热的木炭与CO2反应 | |
| C. | 甲烷在空气中燃烧的反应 | |
| D. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 |
8.某化学兴趣小组要完成中和热的测定.回答下列问题:
实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5mol•L-1盐酸、0.55mol•L-1NaOH溶液,实验尚缺少的玻璃用品是量筒、温度计.
(2)已知:反应后溶液的比热容c为4.18J•℃-1•g-1,0.5mol•L-1盐酸和0.55mol•L-1NaOH溶液的密度均为1g•c
m-3.实验时记录的实验数据如表:
①盐酸和氢氧化钠反应的中和热△H1=-56.8kJ•mol-1(保留两位小数)
②已知:CH3COOH(aq)?CH3COO-(aq)+H+(aq)△H2>0,
CH3COOH(aq)+OH-(aq)=CH3COO-(aq)+H20(l)△H3 则△H3>△H1(填“>”、“<”、“=”)
实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5mol•L-1盐酸、0.55mol•L-1NaOH溶液,实验尚缺少的玻璃用品是量筒、温度计.
(2)已知:反应后溶液的比热容c为4.18J•℃-1•g-1,0.5mol•L-1盐酸和0.55mol•L-1NaOH溶液的密度均为1g•c
m-3.实验时记录的实验数据如表:
| 实验 次数 | 反应物及用量 | 溶 液 温 度 | ||
| t1 | t2 | |||
| 1 | 50mL0.55mol•L-1NaOH溶液 | 50mL.0.5mol•L-1HCl溶液 | 20℃ | 23.3℃ |
| 2 | 50mL0.55mol•L-1NaOH溶液 | 50mL.0.5mol•L-1HCl溶液 | 20℃ | 23.5℃ |
②已知:CH3COOH(aq)?CH3COO-(aq)+H+(aq)△H2>0,
CH3COOH(aq)+OH-(aq)=CH3COO-(aq)+H20(l)△H3 则△H3>△H1(填“>”、“<”、“=”)
18.下列除杂方法错误的是( )
| 括号内为杂质 | 实验操作或方法 | |
| A | NO2(NO) | 通入O2 |
| B | CuSO4溶液(硫酸铁) | 加入足量CuO,过滤 |
| C | 溴苯(溴) | 加入NaOH溶液,分液 |
| D | MnO2(I2) | 加热 |
| A. | A | B. | B | C. | C | D. | D |
5.电离平衡是溶液化学中的重要内容,某化学兴趣小组拟以乙酸为例探究弱酸的性质.
(1)实验一:氢氧化钠标准溶液的配制.
现要配制0.1000mol/LNaOH标准溶液250mL,需要用到的玻璃仪器有玻璃棒、烧杯、胶头滴管和250毫升容量瓶,操作过程中如果没有将烧杯等的洗涤液一并转入容量瓶,在其它操作都正确的情况下,将该标准溶液用来滴定下列(2)中的未知浓度的乙酸溶液,将会使侧定的结果偏高(填“高”、“低”、“不影响”)
(2)实验二:现有一瓶乙酸溶液,常温下测定其中乙酸的电离平衡常数.设计实验方案,将待测物理量和对应的测定方法填写在表一中.
表一:
③上述实验中,如果在某温度时测得乙酸溶液的物质的量浓度为0.1000mol/L,pH=3,则在该温度时乙酸的电离平衡常数为1×10-5.
(3)实验三:探究酸的强弱对酸与镁条反应速率的影响.
①设计实验方案如表二,表二中c=2.0g.
表二:
②实验步骤:
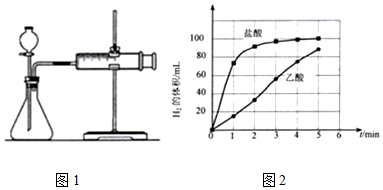
a)图1的装置中,在添加药品之前必须检查装置的气密性;
b)反应开始后,每隔1min记录一次生成H2的体积;
c)将所记录的欲据绘制成曲线图(图2).
③写出镁与乙酸溶液反应的离子方程式:Mg+2CH3COOH=Mg2++2CH3COO-+H2↑.
④描述0~5min盐酸与镁条反应的反应速率变化规律:醋酸与镁条反应的速率随时间变化不明显,盐酸与镁条反应开始阶段反应速率很快,一段时间后反应速率明显减小.
(1)实验一:氢氧化钠标准溶液的配制.
现要配制0.1000mol/LNaOH标准溶液250mL,需要用到的玻璃仪器有玻璃棒、烧杯、胶头滴管和250毫升容量瓶,操作过程中如果没有将烧杯等的洗涤液一并转入容量瓶,在其它操作都正确的情况下,将该标准溶液用来滴定下列(2)中的未知浓度的乙酸溶液,将会使侧定的结果偏高(填“高”、“低”、“不影响”)
(2)实验二:现有一瓶乙酸溶液,常温下测定其中乙酸的电离平衡常数.设计实验方案,将待测物理量和对应的测定方法填写在表一中.
表一:
| 待测物理量 | 测定方法 |
| ①乙酸溶液的物质的量浓度 | 量取25.00mL乙酸溶液于锥形瓶中,滴加指示剂,将0.1000mol/LNaOH标准溶液装入碱式滴定管,滴定至终点,记录数据.重复滴定2次. |
| ②H+的物质的量浓度 | 取适最乙酸溶液于烧杯中,用pH计或精密pH试纸测定溶液pH. |
(3)实验三:探究酸的强弱对酸与镁条反应速率的影响.
①设计实验方案如表二,表二中c=2.0g.
表二:
| 编号 | 酸的种类 | 酸的浓度(mol/L) | 酸的体积/mL | 镁条质量/g |
| l | 乙酸 | 0.5 | 17.0 | 2.0 |
| 2 | 盐酸 | 0.5 | 17.0 | c |

a)图1的装置中,在添加药品之前必须检查装置的气密性;
b)反应开始后,每隔1min记录一次生成H2的体积;
c)将所记录的欲据绘制成曲线图(图2).
③写出镁与乙酸溶液反应的离子方程式:Mg+2CH3COOH=Mg2++2CH3COO-+H2↑.
④描述0~5min盐酸与镁条反应的反应速率变化规律:醋酸与镁条反应的速率随时间变化不明显,盐酸与镁条反应开始阶段反应速率很快,一段时间后反应速率明显减小.
3.1mol H2分子和1mol N2分子一定具有相同的( )
| A. | 电子数 | B. | 原子数 | C. | 质子数 | D. | 体积 |