题目内容
16.设NA为阿佛加德罗常数,下列说法正确的是( )①标准状况下,11.2L以任意比例混合的氮气和氧气所含的原子数为NA
②同温同压下,体积相同的氢气和氩气所含的原子数相等
③2.3克Na与O2完全反应,反应中转移的电子数目介于0.1NA与0.2NA之间
④标准状况下22.4LH2O中分子数为NA
⑤32g O2和O3混合气体中含有原子数为2NA
⑥lmol C12与足量Fe完全反应,反应中转移3NA个电子.
| A. | ①⑤ | B. | ③④⑤ | C. | ①④⑥ | D. | ①②③ |
分析 ①氮气与氧气都是双原子分子,结合阿伏伽德罗定律解答;
②氩气为单原子分子,氢气为双原子分子,结合阿伏伽德罗定律解答;
③钠与氧气反应无论生成氧化钠还是过氧化钠,钠都变为+1价钠离子;
④气体摩尔体积使用对象为气体;
⑤氧气与臭氧都是由氧原子构成,依据n=$\frac{m}{M}$=$\frac{N}{N{\;}_{A}}$计算解答;
⑥氯气与铁反应生成氯化铁,氯气少量,依据氯气的量计算转移电子数.
解答 ①依据阿伏伽德罗定律:同温同压下,相同体积的气体具有相同分子数,可知11.2L以任意比例混合的氮气和氧气物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,氮气与氧气都是双原子分子,所以混合气体含有原子物质的量为1mol,个数为NA,故正确;
②依据阿伏伽德罗定律:同温同压下,体积相同的氢气和氩气具有相同的分子数,但是氩气为单原子分子,氢气为双原子分子,所以二者含有原子数不同,故错误;
③2.3克Na物质的量为:$\frac{2.3g}{23g/mol}$=0.1mol,与O2完全反应生成0.1mol钠离子,转移的电子数目等于0.1NA,故错误;
④标况下,水是液体,不能使用气体摩尔体积,故错误;
⑤32g O2和O3混合气体中含有原子数为$\frac{32g}{16g/mol}$×NA=2NA,故正确;
⑥lmol C12与足量Fe完全反应生成氯化铁,氯气少量完全反应生成2mol氯离子,转移2mol电子,个数为2NA,故错误;
故选:A.
点评 本题考查阿伏加德罗常数的有关计算和判断,熟练掌握以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确气体摩尔体积使用对象,稀有气体为单原子分子的结构特点是解题关键,题目难度不大.

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案
相关题目
6.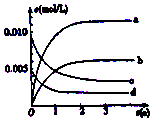 800℃在2L密闭容器内,充入0.020molNO与0.010mol的O2,发生反应2NO(g)+O2(g)?2NO2(g) n(NO)随时间的变化如表:( )
800℃在2L密闭容器内,充入0.020molNO与0.010mol的O2,发生反应2NO(g)+O2(g)?2NO2(g) n(NO)随时间的变化如表:( )
 800℃在2L密闭容器内,充入0.020molNO与0.010mol的O2,发生反应2NO(g)+O2(g)?2NO2(g) n(NO)随时间的变化如表:( )
800℃在2L密闭容器内,充入0.020molNO与0.010mol的O2,发生反应2NO(g)+O2(g)?2NO2(g) n(NO)随时间的变化如表:( )| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO) (mol) | 0.020 | 0.010 | 0.009 | 0.008 | 0.008 | 0.008 |
| A. | a线表示NO2的变化趋势,则0~2s内v(NO2)=0.006mol/(L•s) | |
| B. | 800℃时,该反应的平衡常数K=1125L/mol | |
| C. | 能使该反应的反应速率增大,且平衡向正方向移动的措施是及时分理出NO2 | |
| D. | 已知:K300℃>K350℃,则该反应时吸热反应 |
7.某学习小组按如下实验过程(固定、加热及盛接仪器略)证明了海带中存在碘元素:
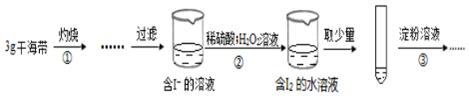
下列说法不正确的是( )

下列说法不正确的是( )
| A. | 步骤①需要将干海带放入坩埚中灼烧 | |
| B. | 步骤②反应的离子方程式为:2I-+2H++H2O2=I2+2H2O | |
| C. | 步骤③操作后,观察到试管中溶液变为蓝色,可以说明海带中含有碘元素 | |
| D. | 若步骤②仅滴加稀硫酸后放置一会儿,步骤③操作后,试管中溶液颜色无明显变化 |
11.下列有关有机物的叙述中,正确的是( )
| A. | 淀粉与纤维素互为同分异构体 | |
| B. | 正丁烷的二氯代物有6种 | |
| C. | 糖类、油脂、蛋白质均为高分子化合物 | |
| D. | 乙烯使酸性高锰酸钾溶液褪色与乙烯使酸性重铬酸钾变色原理不同 |
1.下列各组中化合物的性质比较,正确的是( )
| A. | 稳定性:PH3>H2S>HCl | B. | 碱性:Al(OH)3>Mg(OH)2>NaOH | ||
| C. | 酸性:HIO4>HBrO4>HClO4 | D. | 非金属性:F>O>S |
8.写出下列基团的名称:
-C═C- | ─C≡C─ | ─CH3 | ─CH2CH3 或─C2H5 |
5.下列离子方程式书写正确的是( )
| A. | 醋酸与CaCO3反应:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | FeI2溶液中滴入过量溴水:2Fe2++2I-+2Br2═2 Fe3++I2+4Br- | |
| C. | NaHSO4溶液中滴入少量Ba(OH)2溶液:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| D. | 成分为盐酸的洁厕灵与84消毒液混合使用易中毒:Cl-+ClO-+2H+═Cl2+H2O↑ |
6.SO2的防治与利用对于环境保护意义重大.某小组在实验室中对SO2的性质及回收利用等相关问题进行探究.
(1)用图1装置制备纯净的SO2,发生装置中反应的化学方程式为2NaHSO3+H2SO4═Na2SO4+2H2O+2SO2↑或NaHSO3+H2SO4═NaHSO4+H2O+SO2↑,装置的连接顺序为:a→b→c→g→f→d(按气流方向,用小写字母表示).
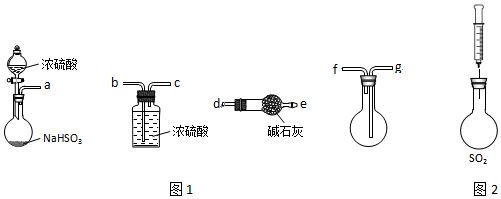
(2)用图2装置探究SO2的性质.限选试剂:NaOH溶液、稀H2SO4、H2O2溶液、FeCl3溶液、淀粉-KI溶液、新制H2S溶液
(3)工业上回收利用SO2的一种途径是:SO2$→_{步骤Ⅰ}^{氨水}$(NH4)2SO3$→_{步骤Ⅱ}^{空气}$(NH4)2SO4,
该小组在实验室探究步骤Ⅱ时,一定条件下向100mL c0mol•L-1的(NH4)2SO3溶液通入空气后,欲测定溶液中(NH4)2SO3的氧化率(α).
①为该小组设计实验方案(不必描述操作过程的细节,物理量的数值用字母表示):
方案1:取20.00mL反应后的溶液于锥形瓶中,用浓度为Cmol/L酸性高锰酸钾溶液滴定,重复滴定三次,平均消耗高锰酸钾的体积为VmL;方案2:向反应后的溶液中加入过量的盐酸,再加入足量的氯化钡溶液,将沉淀过滤、洗涤、干燥、称量,质量为mg.
②α=$\frac{8{C}_{0}-CV}{8{C}_{0}}$或$\frac{m}{23.3{C}_{0}}$×100%(用实验方案中的物理量表示).
(1)用图1装置制备纯净的SO2,发生装置中反应的化学方程式为2NaHSO3+H2SO4═Na2SO4+2H2O+2SO2↑或NaHSO3+H2SO4═NaHSO4+H2O+SO2↑,装置的连接顺序为:a→b→c→g→f→d(按气流方向,用小写字母表示).

(2)用图2装置探究SO2的性质.限选试剂:NaOH溶液、稀H2SO4、H2O2溶液、FeCl3溶液、淀粉-KI溶液、新制H2S溶液
| 操作步骤 | 实验现象 | 解释原因 |
| 用注射器将新制H2S溶液注入充满SO2的烧瓶 | 产生乳白色浑浊 | +4价S有①氧化性 |
| 用注射器将 ②FeCl3溶液溶液注入充满SO2的烧瓶 | ③溶液由棕黄色变成浅绿色 | +4价S有还原性,反应的离子方程式为④2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ |
该小组在实验室探究步骤Ⅱ时,一定条件下向100mL c0mol•L-1的(NH4)2SO3溶液通入空气后,欲测定溶液中(NH4)2SO3的氧化率(α).
①为该小组设计实验方案(不必描述操作过程的细节,物理量的数值用字母表示):
方案1:取20.00mL反应后的溶液于锥形瓶中,用浓度为Cmol/L酸性高锰酸钾溶液滴定,重复滴定三次,平均消耗高锰酸钾的体积为VmL;方案2:向反应后的溶液中加入过量的盐酸,再加入足量的氯化钡溶液,将沉淀过滤、洗涤、干燥、称量,质量为mg.
②α=$\frac{8{C}_{0}-CV}{8{C}_{0}}$或$\frac{m}{23.3{C}_{0}}$×100%(用实验方案中的物理量表示).