题目内容
6.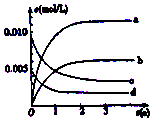 800℃在2L密闭容器内,充入0.020molNO与0.010mol的O2,发生反应2NO(g)+O2(g)?2NO2(g) n(NO)随时间的变化如表:( )
800℃在2L密闭容器内,充入0.020molNO与0.010mol的O2,发生反应2NO(g)+O2(g)?2NO2(g) n(NO)随时间的变化如表:( )| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO) (mol) | 0.020 | 0.010 | 0.009 | 0.008 | 0.008 | 0.008 |
| A. | a线表示NO2的变化趋势,则0~2s内v(NO2)=0.006mol/(L•s) | |
| B. | 800℃时,该反应的平衡常数K=1125L/mol | |
| C. | 能使该反应的反应速率增大,且平衡向正方向移动的措施是及时分理出NO2 | |
| D. | 已知:K300℃>K350℃,则该反应时吸热反应 |
分析 由表中数据可知反应为3s时NO的物质的量不变,说明达到平衡状态.
2NO(g)+O2(g)?2NO2(g)
起始(mol) 0.02 0.01 0
转化(mol) 0.012 0.006 0.012
平衡(mol)0.008 0.004 0.012
根据数据的变化可确定各物质的变化曲线,并以此确定平衡常数,以此解答该题.
解答 解:由表中数据可知反应为3s时NO的物质的量不变,说明达到平衡状态.
2NO(g)+O2(g)?2NO2(g)
起始(mol) 0.02 0.01 0
转化(mol) 0.012 0.006 0.012
平衡(mol)0.008 0.004 0.012
A.二氧化氮为生成物,由以上计算可知达到平衡时物质的量为0.012,浓度为0.006ol/L,则b线表示NO2的变化趋势,故A错误;
B.体积为2L,则800℃时,该反应的平衡常数K=$\frac{0.00{6}^{2}}{0.00{4}^{2}×0.002}$=1125,故B正确;
C.分理出NO2,浓度减小,则反应速率减小,故C错误;
D.K300℃>K350℃,说明升高温度平衡逆向移动,则正反应为放热反应,故D错误.
故选B.
点评 本题考查化学平衡的计算,为高频考点,侧重考查学生的分析能力和计算能力,注意把握表中数据的分析以及曲线的变化,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
17.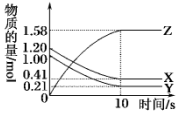 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )| A. | 反应开始到10 s,用X表示的反应速率为0.158 mol•L-1•s-1 | |
| B. | 反应开始到10 s,Y的物质的量浓度减少了0.79 mol•L-1 | |
| C. | 反应10s时达到化学平衡状态,Z的平衡浓度为0.79 mol•L-1 | |
| D. | 反应的化学方程式为2X(g)+2Y(g)?Z(g) |
14.下列各组离子,在指定环境中一定能大量共存的是( )
| A. | pH=7的溶液中:Al3+、K+、SO42-、HCO3- | |
| B. | FeCl2溶液中:SO42-、H+、MnO4-、Na+ | |
| C. | 水电离的c (H+)=1×10-13 mol•L-1:S2-、SO32-、S2O32-、SO42- | |
| D. | 滴加甲基橙试剂显红色的溶液中:Na+、NH4+、Cl-、NO3- |
1.下列事实不能说明亚硝酸( HNO2)是弱电解质的是( )
| A. | HNO2不跟NaCl反应 | |
| B. | NaNO2溶液的pH大于7 | |
| C. | 常温下0.lmol/L HNO2溶液的pH为2.145 | |
| D. | 相同温度下,用相同浓度的HCl溶液和HNO2溶液作导电试验,HNO2溶液灯泡较暗 |
11.下列判断合理的是( )
①硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
②蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质
③根据分散系是否具有丁达尔效应将分散系分为溶液、胶体和浊液
④根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应
⑤根据Na2O、Na2O2组成元素相同,均与H2O反应,故均属于碱性氧化物.
①硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
②蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质
③根据分散系是否具有丁达尔效应将分散系分为溶液、胶体和浊液
④根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应
⑤根据Na2O、Na2O2组成元素相同,均与H2O反应,故均属于碱性氧化物.
| A. | ②④ | B. | ①②④ | C. | ①③⑤ | D. | ②③⑤ |
18.下列物质的水溶液能够导电,但属于非电解质的是( )
| A. | NaOH | B. | CO2 | C. | 蔗糖 | D. | Al |
15.在恒温恒容的容器中,发生反应:H2(g)+CO(g)?C(s)+H2O(g).初始时加入平均相对分子质量为15的H2、CO混合气,一段时间后测得气体的平均相对分子质量为16,下列说法中不正确的是( )
| A. | 反应前后气体的压强之比为4:3 | |
| B. | 反应前后气体的密度之比为l5:16 | |
| C. | H2与CO的转化率相等,均为50% | |
| D. | 若H2与CO按8:5体积比混合,则反应前后混合气体的平均相对分子质量不变 |
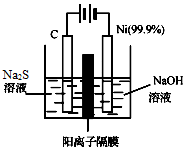 硫及其化合物广泛分布于自然界中,硫酸工业在国民经济中占有极其重要的地位,运用相关原理回答下列问题:
硫及其化合物广泛分布于自然界中,硫酸工业在国民经济中占有极其重要的地位,运用相关原理回答下列问题: